Во время доочистки органические вещества разлагаются с помощью воздуха, что увеличивает количество аэробных бактерий, которые питаются остатками органических веществ и очищают воду. Затем они выпадают в осадок, вода обрабатывается хлором и сбрасывается в водоем. На этой стадии может быть осаждено до 90 % твердых частиц.
Содержание
- 1 Виды воды
- 1.1 Химические названия воды
- 2.1 Физические свойства
- 2.1.1 Агрегатные состояния
- 2.1.2 Изотопные модификации воды
- 4.1 Атмосферные осадки
- 4.2 Вода за пределами Земли
- 5.1 Гидрология
- 5.2 Гидрогеология
- 7.1 Земледелие
- 7.2 Питьё и приготовление пищи
- 7.3 Растворитель
- 7.4 Теплоноситель
- 7.5 Замедлитель
- 7.6 Пожаротушение
- 7.7 Спорт
- 7.8 Инструмент
- 7.9 Смазка
- 13.1 Справочные материалы
- 13.2 Статьи
Вода может существовать на Земле в трех основных состояниях — жидком, газообразном и твердом — и принимать различные формы, которые могут существовать одновременно: Водяной пар и облака в небе, морская вода и айсберги, ледники и реки на поверхности Земли, а также водоносные слои в земле. Вода способна растворять многие органические и неорганические вещества. Из-за важности воды как «источника жизни», ее часто классифицируют на различные типы в соответствии с различными принципами.
Помимо прочего, их различают в зависимости от особенностей происхождения, состава или использования:
- Мягкая вода и жёсткая вода — по содержанию катионов кальция и магния
- По изотопам молекулы:
- Лёгкая вода (по составу почти соответствует обычной)
- Тяжёлая вода (дейтериевая)
- Сверхтяжёлая вода (тритиевая)
- Пресная вода
- Дождевая вода
- Морская вода
- Подземные воды
- Минеральная вода
- Солоноватая вода (en:Brackish water)
- Питьевая вода, Водопроводная вода
- Дистиллированная вода и деионизированная вода
- Сточные воды
- Ливневая вода или поверхностные воды
- Апирогенная вода
- Мёртвая вода и Живая вода — виды воды из сказок (со сказочными свойствами)
- Лёд-девять (вымышленный материал)
- Святая вода — особый вид воды согласно религиозным учениям
- Поливода
- Структурированная вода — термин, применяемый в различных неакадемических теориях.
- Талая вода
Химические названия воды
С формальной точки зрения, вода имеет множество различных правильных химических названий:
- Оксид водорода
- Гидроксид водорода
- Монооксид дигидрогена
- Гидроксильная кислота
- Оксидан
- Дигидромонооксид
Свойства
Физические свойства
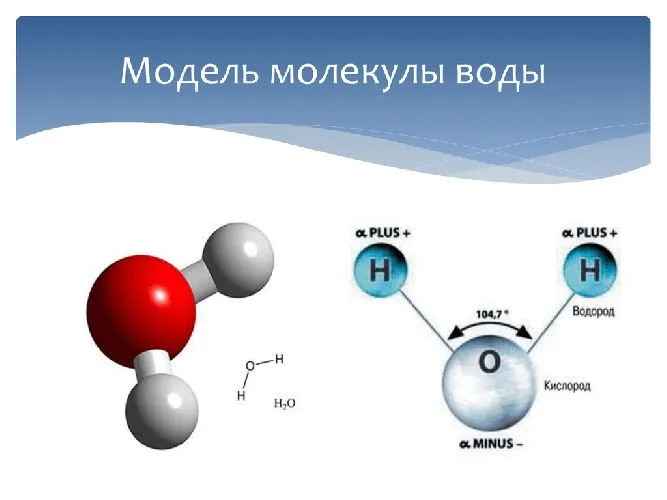
При нормальных атмосферных условиях вода находится в жидком состоянии, в то время как аналогичные водородные соединения являются газообразными. Это связано с особыми свойствами атомов, из которых состоят молекулы, и наличием связей между ними. Атомы водорода связаны с атомом кислорода, образуя угол 104,45°, и эта конфигурация строго сохраняется. Из-за большой разницы в электроотрицательности между атомами водорода и кислорода электронные облака сильно смещены в сторону кислорода. По этой причине молекула воды является активным диполем, у которого кислородная сторона отрицательная, а водородная — положительная. В результате молекулы воды притягиваются к своим противоположным полюсам и образуют полярные связи, для разрыва которых требуется много энергии.2 Как часть каждой молекулы, ион водорода (протон) не имеет внутренних электронных слоев и мал, поэтому он может войти в электронную оболочку отрицательно заряженного атома кислорода соседней молекулы и образовать водородную связь с другой молекулой. Каждая молекула соединена с четырьмя другими водородными связями, две из которых образуют атом кислорода и два атома водорода 2. Сочетание этих связей между молекулами воды — полярных и водородных — определяет очень высокую температуру кипения и удельную теплоту парообразования 2. В результате этих связей в водной среде создается давление 15-20 тысяч атмосфер, что объясняет, почему воду трудно сжать, так что при увеличении атмосферного давления на 1 бар вода сжимается на 0,00005 доли своего первоначального объема 2. До каких пределов изменения давления эта оценка верна?
Структуры воды и льда очень похожи.2 И в воде, и во льду молекулы пытаются расположиться в определенном порядке, чтобы сформировать структуру, но тепловое движение препятствует этому. При температуре перехода в твердое состояние тепловое движение молекул уже не препятствует образованию структуры, и молекулы воды становятся упорядоченными; во время этого процесса объем промежутков между молекулами увеличивается, а общая плотность воды уменьшается, что объясняет более низкую плотность воды в замороженной фазе. При испарении, с другой стороны, все связи разрываются. Для разрыва связей требуется много энергии, поэтому вода имеет самую высокую удельную теплоемкость среди всех других жидкостей и твердых тел. Чтобы нагреть один литр воды на один градус, требуется 4,1868 кДж энергии. Благодаря этому свойству вода часто используется в качестве теплоносителя. Однако, в отличие от других веществ, удельная теплоемкость воды непостоянна: при нагревании от 0 до 35 градусов Цельсия ее удельная теплоемкость уменьшается, в то время как у других веществ она остается постоянной при изменении температуры. Помимо высокой удельной теплоемкости, вода обладает высокой удельной теплотой плавления (0 °C и 333,55 кДж/кг) и испарения (2250 кДж/кг).
Температура °C Удельная теплоемкость воды кДж/(кг*К) -60 (лед) 1,64 -20 (лед) 2,01 -10 (лед) 2,22 0 (лед) 2,11 0 (чистая вода) 4,218 10 4,192 20 4,182 40 4,178 60 4,184 80 4,196 100 4,216 Вода также имеет самое высокое поверхностное натяжение среди жидкостей, уступая только ртути 3 4 5 6. Относительно высокая вязкость воды объясняется тем, что водородные связи не позволяют молекулам воды двигаться с разной скоростью.
Состав воды
Хорошо известно, что все вещества состоят из крошечных частиц, видимых под микроскопом, называемых молекулами. Молекулы имеют сложную структуру и различный состав в зависимости от еще более мелких частиц — атомов.
Вода представляет собой соединение двух химических элементов: Водород и кислород. Оба элемента являются газами, но когда два атома водорода и один атом кислорода объединяются в жидкость, образуется вода.
Природная вода
Природная вода всегда содержит соли или органические вещества. В зависимости от содержания соли природные воды классифицируются как пресные (менее 1 г/л), солоноватые (1-25 г/л), соленые (25-50 г/л) и соленые (более 50 г/л). Речная вода — самая сладкая вода; все варианты встречаются в озерах. Испарение из соленых озер создает отложения питательных солей, солей калия и натрия.
Помимо растворенных солей, в воде содержатся твердые частицы глины или песка, от которых очищается питьевая вода.
Вода, прошедшая через слои чернозема или торфа, имеет коричневый цвет. Цвет определяется органическими соединениями.
Когда вода с любым содержанием солей испаряется и конденсируется на холодной поверхности, получается химически чистая вода. Этот п
Кристаллы воды
Вода — это уникальное вещество на нашей планете, которое может существовать в трех агрегатных состояниях:
Если вы спросите кого-нибудь, что такое вода, самым популярным ответом будет: «Это жидкость». Жидкость — это наиболее распространенное состояние воды в природе.

Физические свойства

Самый распространенный вопрос: «Вода чаще всего встречается в жидком виде?». Наиболее распространенной формой воды является жидкость. В твердом состоянии молекулы расположены ближе друг к другу. В жидком состоянии они находятся дальше друг от друга. В газообразном состоянии они находятся дальше друг от друга, поэтому могут отскакивать друг от друга. При температуре 100°C и выше он представляет собой пар. От 0°C до 100°C — это вода. А ниже 0°C — это лед.
Когда вода замерзает, ее молекулы выстраиваются в правильную шестиугольную форму. Все кристаллы льда выглядят одинаково. Лед обладает уникальным свойством: он легче самой воды, из которой происходит, и не погружается в нее. По этой причине воды всегда замерзают вверху, чтобы жизнь оставалась внизу.
В атмосфере всегда есть крошечные капельки воды. Но мы узнаем о наличии влаги только тогда, когда ее количество увеличивается и образуются облака и туман.
На протяжении веков считалось, что вода — это простое вещество. В 1783 году химику Лавуазье удалось разделить воду на два вещества и предложить их количественное соотношение в одной молекуле.
В нормальных условиях вода не имеет ни вкуса, ни запаха. Вода бесцветна, но когда ее толщина превышает 2 метра, она становится голубой. Это происходит из-за рассеяния коротких лучей солнечного спектра.

Вода является сильным поглотителем солнечной энергии. Вода обладает замечательным свойством медленно нагреваться и медленно остывать. Океаны накапливают тепло летом и отдают его зимой. Это сглаживает температурные колебания на планете. Вблизи водоемов суточные и сезонные колебания температуры меньше. Чем меньше в районе крупных водоемов, тем более континентальным становится климат.
Вот краткий перечень основных сведений о воде, ее составе и свойствах:
Что мы узнали?
- Молекула воды состоит из 2-х атомов водорода и 1 атома кислорода
- Лед легче воды
- Вода – единственное на планете вещество, способное пребывать в трех агрегатных состояниях: газообразном, твердом, жидком
- В воде всегда присутствуют примеси
- Количество морской воды на планете гораздо больше, чем пресной
- Вода регулирует температуру планеты