Такие процессы, как испарение и конденсация, становятся более логичными и простыми, если рассматривать их на примере влажности.
Агрегатные состояния вещества
Чтобы понять общую ситуацию, предлагаю вам заполнить таблицу по ходу чтения статьи.
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы.
Лед, вода и пар — это три агрегатных состояния вещества. Лед — это твердое состояние, вода — жидкое состояние, а пар — газообразное состояние. Для каждого вещества существует три состояния.
Твердое состояние
Его очень легко представить — это каждый предмет, с которым мы сталкиваемся в жизни. В таком состоянии тело сохраняет свою форму и объем. Расстояние между молекулами примерно равно размеру самих молекул, которые, в свою очередь, расположены очень структурированно.
Такая структура называется кристаллической решеткой — дискретная структура затрудняет движение молекул, и они просто колеблются вокруг своих равновесных положений.
Давайте заполним нашу таблицу
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы.
Сохранение формы и объема
в кристаллической решетке
коррелирует с размером молекул
осциллирует вокруг своего положения в кристаллической решетке
Жидкое состояние
В этом состоянии сохраняется объем, но не форма. Например, если вы наливаете молоко из кувшина в стакан, молоко, которое имело форму кувшина, принимает форму стакана. Коровье молоко, кстати, тоже имело другую форму.

Расстояние между молекулами в жидком состоянии немного больше, чем в твердом, но все равно небольшое. При этом частицы не собраны в кристаллическую решетку, а расположены хаотично. Молекулы почти не двигаются, но когда жидкость нагревается, они двигаются легче.
Подумайте, что происходит, когда вы заливаете холодной водой чайный пакетик: он почти никогда не черствеет. Но если залить его кипятком, то он точно готов к чаепитию.
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы.
Сохранение формы и объема
в кристаллической решетке
коррелирует с размером молекул
осциллирует вокруг своего положения в кристаллической решетке
близко друг к другу
медленные; при нагревании скорость движения молекул увеличивается.
Газообразное состояние
В жизни мы сталкиваемся с газообразным состоянием вещества, когда чувствуем его запах. Запах распространяется очень легко, потому что газ не имеет формы и объема (он занимает весь отведенный ему объем); он состоит из хаотично движущихся молекул, расстояние которых друг от друга больше, чем размер молекул.
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы.
Сохранение формы и объема
в кристаллической решетке
коррелирует с размером молекул
осциллирует вокруг своего положения в кристаллической решетке
Фазовые переходы: изменение агрегатных состояний вещества
При изменении внешних условий (например, когда внутренняя энергия тела увеличивается или уменьшается вследствие нагревания или охлаждения) могут происходить фазовые переходы — изменения в состоянии материи.
Фазовые переходы интересны тем, что все живые существа на Земле существуют только потому, что вода может превращаться в лед или пар. Многие процессы в металлургии и микроэлектронике включают кристаллизацию, плавление, парообразование и конденсацию.
Названия всех фазовых переходов приведены на диаграмме:
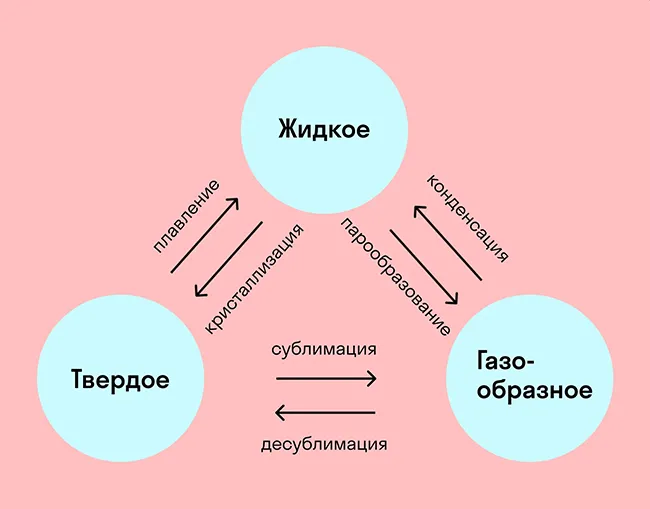
Переход из твердого состояния в жидкое — плавление,
переход из жидкого состояния в твердое — кристаллизация,
переход из газообразного состояния в жидкое — конденсация,
переход из жидкого состояния в газообразное — образование паров,
Переход из твердого состояния в газообразное, минуя жидкое состояние — сублимация,
Переход из газообразного состояния в твердое, минуя жидкое состояние — декомпрессия.
График фазовых переходов
Если мы рассмотрим процесс превращения льда в воду, воды в пар и наоборот, то получим очень информативную диаграмму.
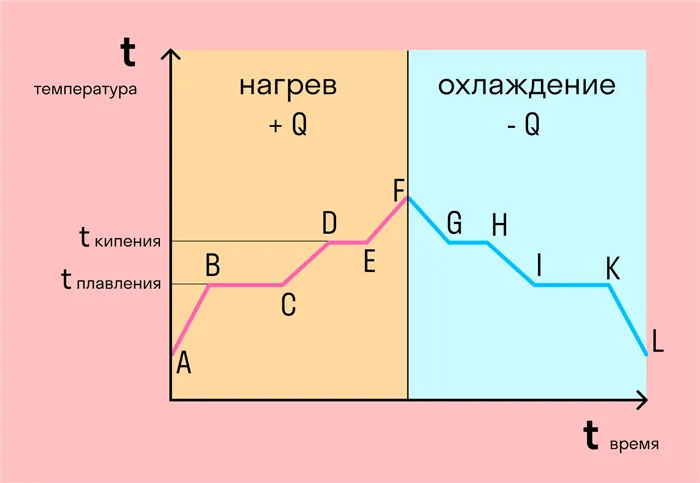
Давайте делать по одному шагу за раз.
Во-первых, конечно, мы брали лед при температуре ниже нуля, потому что при нуле градусов лед начинает таять. Мы нагрели лед до температуры плавления (0 градусов Цельсия).
Как только лед нагревается до температуры плавления, он начинает таять. В точке B это все еще лед, а в точке C — уже вода. Плавление происходит при постоянной температуре и длится до тех пор, пока масса плавящегося вещества увеличивается. Это также зависит от свойств вещества, к которым мы вернемся позже.
Расплавленный материал в жидком состоянии снова нагревается, и температура повышается до точки кипения. В этом случае вода нагревается, что означает, что ее температура кипения составляет 100 градусов Цельсия.
- DE — кипение (парообразование) воды
При температуре 100 градусов Цельсия вода кипит до тех пор, пока полностью не выкипит. В этом случае процесс, как и плавление, происходит при постоянной температуре. Однако не следует путать испарение с выпариванием, так как выпаривание происходит при определенной температуре, в то время как испарение происходит при любой температуре.
Полученный пар затем нагревают, но при нагревании невозможно достичь другого фазового перехода — можно только двигаться в обратном направлении.
Первый шаг назад — охлаждение до температуры кипения.
После достижения точки кипения (в данном случае 100 градусов) пар начинает переходить в жидкое состояние. Этот процесс также происходит при постоянной температуре.
После того как вода сконденсировалась, ее охлаждают до тех пор, пока она не начнет замерзать.
Вода кристаллизуется (замерзает) при той же температуре, при которой тает лед, т.е. при 0 градусов Цельсия. Кристаллизация также происходит при постоянной температуре.
После кристаллизации лед охлаждают.
При нагревании и охлаждении все очень просто: либо мы отдаем тепло телу (веществу) и температура повышается, либо тело отдает тепло и охлаждается.
Решение задач по фазовым переходам
Мы разобрались с теорией — теперь пришло время для практики!
Первая проблема. Температура образца меди массой 100 г повысилась с 20°C до 60°C. Сколько тепла получил образец? Предположим, что удельная теплоемкость меди составляет 380 Дж/(кг — °C).
-
Сначала переведите массу в килограммы:
Q = 380 — 0,1 — (60 — 20) = 1520 ДЖ
Ответ: Образец получил 1520 Дж
Проблема вторая. Какое количество тепла необходимо для того, чтобы расплавить 2,5 тонны стали при температуре ее плавления? Удельная теплота плавления стали составляет λ = 80 кДж/кг. Потерями тепла следует пренебречь.
-
Сначала переведите массу в килограммы и удельную теплоту в Дж/кг:
80 кДж/кг = 80 000 Дж/кг
Q = 80 000 — 2500 = 200 000 000 J = 200 MJ
Ответ: Чтобы расплавить 2,5 тонны стали, требуется 200 МДж тепла.
Выполняйте физические упражнения 15 минут в день. Освоить английскую грамматику и лексику. Сделайте язык частью своей жизни.

Фазовые переходы
Переход вещества из одного состояния материи в другое называется фазовым переходом, поскольку научным синонимом состояния материи является фаза вещества. Например, вода может существовать в твердой фазе (лед), жидкой фазе (обычная вода) и газовой фазе (водяной пар).
Сублимацию также можно хорошо продемонстрировать на примере воды. Белье, вывешенное сушиться во дворе в холодный безветренный день, сразу же замерзает, но через некоторое время оказывается сухим: лед остается и сразу же превращается в водяной пар.
Фазовый переход из твердого состояния в жидкое и газообразное обычно требует нагревания, при этом температура среды не повышается: Тепловая энергия используется для разрушения внутренних связей вещества. Это так называемая скрытая теплота фазового перехода. При обратных фазовых переходах (конденсация, кристаллизация) это тепло выделяется.
Именно поэтому ожоги паром так опасны. При соприкосновении с кожей он конденсируется. Скрытая теплота парообразования/конденсации воды очень высока: вода является аномальным веществом в этом отношении; именно поэтому на Земле возможна жизнь. При ожоге паром скрытая теплота конденсации воды очень глубоко «пропаривает» обожженное место, и последствия ожога паром гораздо серьезнее, чем последствия ожога пламенем на том же участке тела.
Псевдофазы
Текучесть жидкой фазы вещества определяется его вязкостью, а вязкость определяется природой его внутренних связей, чему посвящен следующий раздел. Вязкость жидкости может быть очень высокой, и такая жидкость может течь незаметно для глаза.
Классический пример — стекло. Это не твердое вещество, а очень вязкая жидкость. Обратите внимание, что на складах стекло никогда не хранится прислоненным к стене. Уже через несколько дней они проседают под собственным весом и становятся непригодными для использования.
Другими примерами псевдотвердых веществ являются крем для обуви и строительный асфальт. Если вы оставите на крыше угловой кусок битума, летом он отслоится и прилипнет к основанию. Псевдотвердые вещества отличаются от настоящих твердых веществ способом плавления: настоящие твердые вещества либо сохраняют свою форму до момента плавления (прилипание при склеивании), либо плавятся, оставляя выбоины и трещины (лед). А очень вязкие жидкости размягчаются постепенно, как, например, варенье или сам асфальт.
Высоковязкие жидкости, текучесть которых прекратилась за годы или десятилетия, являются пластичными. Их высокая размерная стабильность обусловлена огромным молекулярным весом полимеров, который исчисляется тысячами или миллионами атомов водорода.
Структура фаз вещества
В газовой фазе молекулы или атомы вещества находятся на большом расстоянии друг от друга, во много раз превышающем расстояние между ними. Они взаимодействуют друг с другом редко и нерегулярно, только через столкновения. Само взаимодействие упругое: они сталкиваются как твердые шары и тут же снова разлетаются в стороны.
В жидкости молекулы/атомы постоянно «чувствуют» друг друга через очень слабые химические связи. Эти связи постоянно разрываются и тут же восстанавливаются, молекулы в жидкости постоянно перемещаются относительно друг друга, поэтому жидкость течет. Однако, чтобы превратиться в газ, все связи должны разорваться одновременно, а для этого требуется много энергии, поэтому жидкость сохраняет свой объем.
Например, если читатель видел сломанную автомобильную ось или чугунную решетку, зерна кристаллитов в изломе видны невооруженным глазом. А в осколках разбитой фарфоровой или фаянсовой посуды можно рассмотреть под лупой.
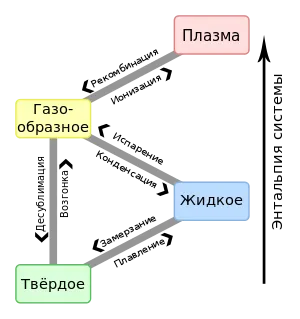
В этом разделе мы рассмотрим состояния материи, которые нас окружают, и силы взаимодействия между частицами, присущие каждому из этих состояний материи. Предполагается, что материя может существовать в одном из трех агрегатных состояний: 1. твердое состояние, 2. жидкое состояние и 3. газообразное состояние. Часто выделяют четвертое состояние материи — плазму. Иногда плазму также рассматривают как разновидность газообразного состояния.
Плазма — это частично или полностью ионизированный газ, который обычно возникает при высоких температурах. Плазма — самое распространенное состояние материи во Вселенной, потому что она является состоянием материи.
Х и м и я

Каждое состояние материи характеризуется особенностями взаимодействия частиц вещества, которые влияют на их физические и химические свойства. Любое вещество может находиться в различных агрегатных состояниях. При достаточно низких температурах все вещества находятся в твердом состоянии. Однако при нагревании они становятся сначала жидкими, а затем газообразными. При дальнейшем нагревании они ионизируются (атомы теряют часть своих электронов) и переходят в состояние плазмы.
Газообразное состояние (от голландского «газ», происходящего от греческого «хаос») характеризуется очень слабыми связями между составляющими его частицами. Молекулы или атомы, составляющие газ, движутся хаотично и большую часть времени находятся на больших расстояниях (относительно своего размера) друг от друга. Поэтому силы взаимодействия между частицами газа пренебрежимо малы. Основная характеристика газа заключается в том, что он заполняет все доступное пространство, не образуя поверхности. Газы всегда смешиваются. Газ изотропен, т.е. его свойства не зависят от направления. В отсутствие гравитационных сил давление одинаково во всех точках газа. В присутствии гравитационных сил плотность и давление не одинаковы в каждой точке и уменьшаются с высотой. Следовательно, газовая смесь становится неоднородной в гравитационном поле. Более тяжелые газы имеют тенденцию оседать ниже, а более легкие — подниматься выше. Газ обладает высокой сжимаемостью — его плотность увеличивается с ростом давления. Они расширяются при повышении температуры. Когда газ сжимается, он может превратиться в жидкость, но конденсация происходит не при любой температуре, а только при температуре ниже критической. Критическая температура характерна для конкретного газа и зависит от сил взаимодействия между его молекулами. Например, газ гелий может сжижаться только при температуре ниже 4,2 К. Существуют газы, которые при охлаждении переходят в жидкую фазу. Превращение жидкости в газ называется испарением, а прямое превращение твердого тела в газ — сублимацией.
Твердое состояние характеризуется стабильностью размеров по сравнению с другими инертными состояниями. Различают кристаллические и аморфные твердые вещества.
Газ
Кристаллическая атомная решетка.
Жидкость — это промежуточное состояние между твердым телом и газом.
Кристаллическое состояние вещества
Стабильность формы твёрдых тел связана с тем, что большинство, находящихся в твёрдом состоянии имеет кристалическое строение. В этом случае расстояния между частицами вещества малы, а силы взаимодействия между ними велики, что и определяет стабильность формы. В кристаллическом строении многих твёрдых тел легко убедиться, расколов кусок вещества и рассмотрев полученный излом. Обычно на изломе (например, у сахара, серы, металлов и пр.) хорошо заметны расположенные под разными углами мелкие грани кристаллов, поблескивающие вследствии различного отражения ими света. В тех случаях, когда кристаллы очень малы, кристаллическое строение вещества можно установить при помощи микроскопа. Формы кристаллов Каждое вещество образует кристаллы совершенно определённой формы. Разнообразие кристаллических форм может быть сведено к семи группам: 1. Триклинная (параллелепипед), 2. Моноклинная (призма с параллелограммом в основании), 3. Ромбическая (прямоугольный параллелепипед), 4. Тетрагональная (прямоугольный параллелепипед с квадратом в основании), 5. Тригональная, 6. Гексагональная (призма с основанием правильного центрированного шестиугольника), 7. Кубическая (куб). Многие вещества, в частности железо, медь, алмаз, хлорид натрия кристализуются в кубической системе. Простейшими формами этой системы являются куб, октаэдр, тетраэдр. Магний, цинк, лёд, кварц кристализуются в гексагональной системе. Основные формы этой системы – шестигранные призмы и бипирамида. Природные кристаллы, а также кристаллы, получаемые искусственным путём, редко в точности соответствуют теоретическим формам. Обычно при затвердевании расплавленного вещества кристаллы срастаются вместе и потому форма каждого из них оказывается не вполне правильной. Однако как бы неравномерно не происходило развитие кристалла, как бы ни была искажена его форма, углы, под которыми сходятся грани кристалла у одного и того же вещества остаются постоянными. Анизотропия Особенности кристаллических тел не ограничиваются только формой кристаллов. Хотя вещество в кристалле совершенно однородно, многие из его физических свойств – прочность, теплопроводность, отношение к свету и др. – не всегда одинаковы по различным направлениям внутри кристалла. Эта важная особенность кристаллических веществ называется анизотропией. Внутреннее строение кристаллов. Кристаллические решётки. Внешняя форма кристалла отражает его внутреннее строение и обусловлена правильным расположением частиц, составляющих кристалл, — молекул, атомов или ионов. Это расположение можно представить в виде кристаллической решётки – пространственного каркаса, образованного пересекающимися прямыми линиями. В точках пересечения линий – узлах решётки – лежат центры частиц.
Многие вещества, в частности железо, медь, алмаз, хлорид натрия кристализуются в кубической системе. Простейшими формами этой системы являются куб, октаэдр, тетраэдр. Магний, цинк, лёд, кварц кристализуются в гексагональной системе. Основные формы этой системы – шестигранные призмы и бипирамида. Природные кристаллы, а также кристаллы, получаемые искусственным путём, редко в точности соответствуют теоретическим формам. Обычно при затвердевании расплавленного вещества кристаллы срастаются вместе и потому форма каждого из них оказывается не вполне правильной. Однако как бы неравномерно не происходило развитие кристалла, как бы ни была искажена его форма, углы, под которыми сходятся грани кристалла у одного и того же вещества остаются постоянными. Анизотропия Особенности кристаллических тел не ограничиваются только формой кристаллов. Хотя вещество в кристалле совершенно однородно, многие из его физических свойств – прочность, теплопроводность, отношение к свету и др. – не всегда одинаковы по различным направлениям внутри кристалла. Эта важная особенность кристаллических веществ называется анизотропией. Внутреннее строение кристаллов. Кристаллические решётки. Внешняя форма кристалла отражает его внутреннее строение и обусловлена правильным расположением частиц, составляющих кристалл, — молекул, атомов или ионов. Это расположение можно представить в виде кристаллической решётки – пространственного каркаса, образованного пересекающимися прямыми линиями. В точках пересечения линий – узлах решётки – лежат центры частиц.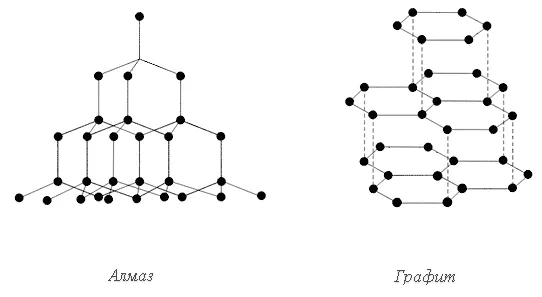 В зависимости от природы частиц, находящихся в узлах кристаллической решётки, и от того, какие силы взаимодействия между ними преобладают в данном кристалле, различают следующие виды кристаллических решёток : 1. молекулярные, 2. атомные, 3. ионные и 4. металлические. Молекулярные и атомные решётки присущи веществам с ковалентной связью, ионные – ионным соединениям, металические – металам и их сплавам.
В зависимости от природы частиц, находящихся в узлах кристаллической решётки, и от того, какие силы взаимодействия между ними преобладают в данном кристалле, различают следующие виды кристаллических решёток : 1. молекулярные, 2. атомные, 3. ионные и 4. металлические. Молекулярные и атомные решётки присущи веществам с ковалентной связью, ионные – ионным соединениям, металические – металам и их сплавам.
Жидкость — это промежуточное состояние между газообразным и кристаллическим состоянием. Некоторые свойства жидкостей похожи на свойства газов, некоторые — на свойства твердых тел.
Жидкости
Что сближает жидкости с газами, так это их изотропия и текучесть. Последнее объясняется способностью жидкостей легко менять свою форму.
Однако высокая плотность и низкая сжимаемость жидкостей приближают их к твердым телам.
Способность жидкостей легко менять свою форму свидетельствует об отсутствии сил межмолекулярного взаимодействия.
В то же время низкая сжимаемость жидкостей, связанная с их способностью сохранять постоянный объем при заданной температуре, указывает на наличие значительной, хотя и не жесткой, силы взаимодействия между частицами.
Взаимосвязь между динамической и кинетической энергией.
Каждое состояние материи имеет свое собственное соотношение между динамической и кинетической энергией частиц материи.
В твердых телах средняя динамическая энергия частиц больше их средней кинетической энергии. Поэтому в твердых телах частицы занимают определенные позиции по отношению друг к другу и колеблются только относительно этих позиций.
В газах соотношение энергий обратное, поэтому молекулы газов всегда находятся в состоянии хаотического движения и между молекулами почти нет сил сцепления, поэтому газ всегда занимает весь предполагаемый объем.
В жидкостях кинетическая и потенциальная энергия частиц приблизительно равны, т.е. частицы связаны друг с другом, но не являются жесткими. Поэтому жидкости текучи, но имеют постоянный объем при определенной температуре.
Структуры жидкостей и аморфных тел схожи.
Методы структурного анализа, применяемые к жидкостям, показали, что жидкости структурно подобны аморфным телам. В большинстве жидкостей существует приблизительный порядок — число ближайших соседей каждой молекулы и их относительное положение примерно одинаково по всему объему жидкости.
Степень упорядоченности частиц варьируется от жидкости к жидкости. Он также изменяется в зависимости от температуры.
При низких температурах, чуть выше температуры плавления рассматриваемой жидкости, степень упорядоченности частиц высока.
При повышении температуры она уменьшается, а при повышении температуры свойства жидкости становятся более похожими на свойства газа. Как только достигается критическая температура, разница между жидкостью и газом исчезает.
Из-за сходства внутренней структуры жидкостей и аморфных тел последние часто рассматриваются как жидкости с очень высокой вязкостью, в то время как твердые тела считаются только кристаллами.
Однако, сравнивая аморфные тела с жидкостями, следует отметить, что в аморфных телах, в отличие от обычных жидкостей, частицы имеют ничтожно малый Mob
С точки зрения термодинамического описания газообразные вещества могут существовать в двух фазах: в виде насыщенных паров и в виде перегретых паров. Насыщенный пар — это состояние газообразного вещества, в котором при определенных условиях возможен фазовый переход в жидкое или даже твердое состояние. В виде перегретых паров свойства вещества близки к свойствам идеальных газов.
Газы обладают таким свойством, как текучесть; подобно жидкостям, их элементарные компоненты движутся под действием минимальных сил. Химический состав газов сильно различается: газы могут быть как инертными, так и взрывоопасными веществами, способными нанести большой ущерб даже небольшой искрой.
Газообразные вещества
Одно и то же вещество может существовать в разных общих состояниях в разное время и при разных внешних условиях.
Фазовый переход в веществах — переход из одного агрегатного состояния в другое при изменении внешних условий.
Процесс отрыва молекул от поверхности жидкости или твердого тела называется испарением. Чтобы вырваться из объема вещества, кинетическая энергия молекулы должна превысить энергию, связывающую молекулу с другими элементарными частицами вещества. Интенсивное испарение приводит к переходу всего количества вещества в другое агрегатное состояние.
В процессе испарения образуются пары. Сам процесс представляет собой фазовый переход.
Фазовые переходы веществ
Насыщенный пар — это пар, который находится в термодинамическом равновесии с жидкостью или твердым объектом того же химического состава. Выражение для внутренней энергии:
$\треугольник U=\pm mr$, (1)
m — масса тела,
r — удельная теплота парообразования (Дж/кг).
Характерным параметром насыщенного пара является его давление, которое зависит от температуры. Если внешнее давление ниже давления насыщенного пара, начинается кипение или сублимация (для твердых веществ). В обратном случае происходит конденсация и расширение.
Вещество может переходить из состояния насыщенного и ненасыщенного пара в жидкое состояние. Процесс трансформации называется конденсацией.
Внутренняя энергия изменяется в соответствии с выражением (1) определения 6.
При изменении внешних условий, например, при повышении температуры, твердое вещество в определенный момент времени начинает плавиться, т.е. переходит из твердого состояния в жидкое.
Повышение температуры приводит к увеличению внутренней энергии, что вызывает увеличение интенсивности движения молекул вещества. Температура плавления указывает на точку, в которой начинается распад кристаллической решетки. Силы, связывающие молекулы, ослабевают. Когда достигается точка плавления, температура самого вещества остается постоянной, а весь
Для учета теплопередачи при нагревании, охлаждении и фазовых переходах необходимо использовать уравнение теплового баланса. Таким образом, можно учесть все виды тепловой энергии, которая поглощается и генерируется в исследуемой системе.
$Q_1+Q_2+. +Q_n=Q’_1+Q’_2+. +Q’_k$
Уравнение теплового баланса аналогично закону сохранения энергии для термодинамических процессов.
Рассмотрим систему, в которой отсутствует теплообмен с внешней средой. Пусть эта система имеет емкость с водой и льдом. Температура внутри контейнера равна $t_i = 0^\circ C$. Определите массы веществ $m_i$ (вода), $m_i$ (лед). Их значения составляют 0,5 кг и 60 г соответственно.
В этом случае частицы АС химических элементов и их соединений связаны лишь слабо или не связаны вообще и заполняют весь прогнозируемый объем. Это состояние материи широко распространено в природе: Газовые массы в атмосфере, скопления газа под землей, газообразные вещества, растворенные в воде океанов.
Все газы характеризуются следующими свойствами:
Эти свойства определяются большими расстояниями между молекулами и притяжением между ними. Газообразное состояние вещества можно рассматривать как перегретый или ненасыщенный пар. При чрезвычайно высоких температурах газ частично или полностью ионизируется, сохраняя при этом общую электрическую нейтральность, поскольку плотности отрицательных и положительных зарядов примерно равны.
В результате образуется плазма, которую некоторые ученые считают четвертым типом материи. Взаимодействие между ионами и свободными электронами происходит посредством электрических сил, действующих на большом расстоянии. Вещества, которые обычно находятся в газообразном состоянии, не могут самопроизвольно перейти в жидкое состояние.
Увеличение давления и снижение температуры приводит к уменьшению расстояния между молекулами и увеличению силы взаимодействия настолько, что вещество переходит из газообразного состояния в жидкое, т.е. изменяет свой AC. Этот процесс называется сжижением и характеризуется критической температурой. Она определяется как точка, выше которой газ больше не может быть превращен в жидкость при любом давлении.
Критическая температура имеет свое собственное значение для каждого газообразного вещества. Она может быть приблизительно равна комнатной температуре, поскольку в случае аммиака, хлора и углекислого газа давление газа достаточно для его сжижения. Водород и гелий, например, имеют критическую температуру намного ниже комнатной. Перед сжижением их сначала охлаждают немного ниже критической температуры, а затем доводят до температуры жидкого АС под повышенным давлением.
Различие между твердыми, жидкими и газообразными веществами обусловлено внутренними процессами, которые зависят от общего состояния вещества. В таблице приведены характеристики каждой категории.
Состояние материи
Организация и характер движения частиц
Энергия взаимодействия
Физические свойства
Твердые вещества
Расстояния между частицами, колеблющимися вблизи позиций
Они сохраняют объем, но не форму. Готовьте при определенной температуре. Жидкий, почти несжимаемый.
Газообразное состояние
Газы
Хаотично расположенные частицы на расстояниях, значительно превышающих их размеры. Хаотичное движение частиц с достаточно высокой скоростью приводит к постоянным столкновениям между ними.
- равномерно заполняют весь предоставленный объем, при этом не создавая поверхность;
- имеют малую плотность при высокой скорости диффузии;
- сравнительно легко сжимаются.

Кинетическая энергия по модулю намного больше потенциальной энергии. Они легко заполняют весь прогнозируемый объем и сжимаются.
Они принимают форму предметов, в которых находятся.
Следует отметить, что переход вещества из одного переменного тока в другой зависит от соотношения динамической и кинетической энергии его частиц.
Способность металлов плавиться и работать в жидком состоянии широко используется в черной и цветной металлургии. Соли и другие химические соединения получают путем выпаривания, когда желаемое вещество получается после испарения жидкости. Использование сжиженных газов широко распространено в различных областях промышленности и техники.
Сравнительная таблица
Инертные газы используются в осветительных приборах, жидкий кислород применяется в медицине в качестве анестетика и смешивается с ацетиленом при сварке металлов.
| Жидкий водород — это ракетное топливо, а оксид серы убивает плесень. Жидкий аммиак используется в холодильниках и промышленных морозильных камерах, а сжиженные газы также легче транспортировать. | |||
Область применения