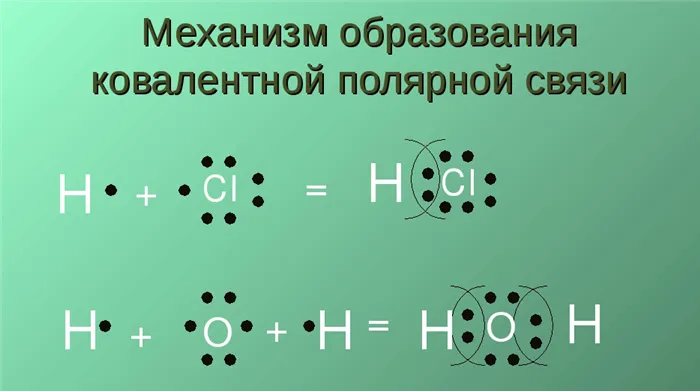
Ковалентная связь донор-рецептор существует, когда одна частица, в данном случае донор, предлагает свою электронную пару для связи, а вторая, акцептор, предоставляет свободную орбиталь.
Ковалентная связь – что это такое, какими характеристиками обладает
Само слово комбинация содержит в своем названии два латинских слова: «co», что означает «вместе», «сообща» и «vales» — обладать силой. Исходя из этимологии термина, можно сделать вывод, что ковалентная связь образуется парой электронов, принадлежащих одновременно обоим атомам. Проще говоря, между этими атомами образуется связь благодаря двум общим электронам. И эта связь характерна только для неметаллических атомов; она может возникать как в атомах кристаллов, так и в атомах молекул.
Ковалентная связь была открыта в начале 20-го века американским химиком Дж. Льюисом. Первоначально существование такой связи было лишь гипотезой и мыслью, которая затем была подтверждена экспериментами и испытаниями. И что же выяснили ученые? Оказалось, что электромагнетизм, характерный для неметаллов, может быть усилен взаимодействием двух атомов. В этом случае перенос электронов между ними не может состояться, и тогда эти электроны объединяются, образуя ковалентную связь.
Какие существуют виды ковалентной связи
Таким образом, существует два типа: донорно-акцепторная связь и обменная связь.
Последнее предполагает, что каждый из связывающих атомов отдает 1 несвязанный электрон для создания этой ковалентной связи. В то же время они должны иметь противоположные заряды. Пример такой связи можно найти в молекуле водорода. Поэтому, когда атомы движутся навстречу друг другу, их электронные облака сливаются (происходит так называемое «перекрытие»). Это увеличивает электронную плотность между самими ядрами, они сильно притягиваются друг к другу, и сама энергетическая система уменьшается. Однако если ядра оказываются слишком близко друг к другу, они отталкиваются друг от друга, пока не будет достигнуто оптимальное расстояние.
Другой тип связи, донорно-акцепторный, возникает, когда одна из частиц, являющаяся донором, «жертвует» пару электронов для образования этой связи, а другая, являющаяся акцептором, жертвует свободную орбиталь, необходимую для этого.
Существуют и другие типы ковалентных связей: неполярные и полярные, которые будут рассмотрены ниже.
Неполярный тип
Пример образования неполярной связи показан на рисунке. Очевидно, что это происходит между одними и теми же атомами.
Поэтому в молекулах общие электронные пары равноудалены от атомных ядер. Кислород является примером, иллюстрирующим эту ситуацию. В его молекуле (как показано на рисунке) атомы имеют «расположение» из 8 электронов, а также 4 общих электронных пар.
К материалам, образующим неполярную ковалентную связь, относятся жидкости, газы и низкоплавкие твердые вещества.
Полярный тип
Этот тип ковалентной связи возникает, когда атомы, которые соединяются вместе, отличаются по своей электроотрицательности. В этом случае электроны, входящие в связь, неравномерно связаны с двумя атомами. Обратите внимание, что эти электроны остаются около одного из атомов в течение значительной части времени связи.
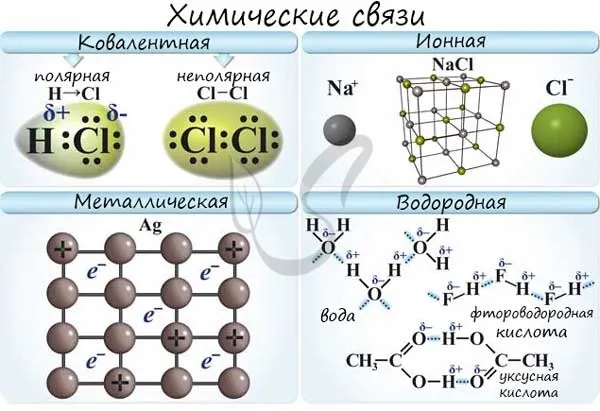
Примером полярного типа является молекула хлористого водорода. Поэтому электроны, участвующие в связи, находятся ближе к атому водорода, чем к атому хлора. Это связано с тем, что последний имеет гораздо более высокую электроотрицательность.
Пример полярной ковалентной связи можно найти в повседневной жизни в воде.
Как выявляется ковалентная связь
Чтобы точно знать, как он образуется и какие существуют типы, достаточно знать химическую формулу рассматриваемой молекулы и ее свойства. Таким образом, если молекула содержит атомы разных элементов, то образовавшуюся связь можно считать полярной, если же она состоит только из одного элемента, то неполярной.
Другой важный вывод по этому вопросу заключается в том, что ковалентные связи образуются в основном у неметаллов, что подтверждается природой образования самих таких связей.
Образование связи
Ковалентная связь (атомная связь, ковалентная связь) — это связь между двумя атомами, обусловленная совместным использованием двух электронов — по одному от каждого атома:
По этой причине ковалентная связь является направленной. Например, электронная пара связи принадлежит одновременно обоим связанным атомам:
| .. | .. | .. | |||||||
| : | Cl | : | Cl | : | H | : | O | : | H |
| .. | .. | .. |
Виды ковалентной связи
Существует три типа ковалентных химических связей, которые различаются по механизму образования:
1. простая ковалентная связь: Для их образования каждый из атомов отдает неспаренный электрон. При образовании простой ковалентной связи заряды атомов остаются неизменными. Если атомы, образующие простую ковалентную связь, одинаковы, то фактические заряды атомов в молекуле также одинаковы, поскольку атомы, образующие связь, также имеют неспаренную электронную пару, такая связь называется неполярной ковалентной связью. Если атомы разные, то степень обладания электронной парой определяется разницей в электроотрицательности атомов, атом с большей электроотрицательностью обладает большей связующей электронной парой и поэтому его эффективный заряд имеет отрицательный знак, атом с меньшей электроотрицательностью соответственно получает такой же заряд, но с положительным знаком.
2. донорно-акцепторная связь. В этом типе ковалентной связи оба электрона предоставляются одним из атомов (донором), а второй из атомов, участвующих в образовании связи, называется акцептором. В полученной молекуле стандартный заряд донорного атома увеличивается на единицу, а стандартный заряд акцепторного атома уменьшается на единицу.
3. полуполярная связь. Этот тип ковалентной связи образуется между атомом с одной неспаренной электронной парой (азот, фосфор, сера, галоген и т.д.) и атомом с двумя неспаренными электронами (кислород, сера). Образование полуполярной связи происходит в два этапа:
1. 1. Окисление (передача электрона) атома с БОТ атомом с двумя неспаренными электронами. В результате атом NEP превращается в радикальный катион (положительно заряженная частица с одним неспаренным электроном), а атом с двумя неспаренными электронами — в радикальный анион (отрицательно заряженная частица с одним неспаренным электроном).
(2) Неспаренные электроны si
, его электронная формула: H:C::C::C::C:H. Ядра всех атомов этилена лежат в одной плоскости. Три электронных облака каждого атома углерода образуют три ковалентные связи с другими атомами в одной плоскости (с углами между ними около 120°). Четвертое валентное электронное облако атома углерода находится выше и ниже плоскости молекулы. Эти электронные облака двух атомов углерода частично перекрываются над и под плоскостью молекулы и образуют вторую связь между атомами углерода. Первая, более прочная ковалентная связь между атомами углерода называется σ-связью; вторая, менее прочная ковалентная связь называется π-связью.
Простые ковалентные связи соединяют атомы в молекулах простых газов (H
CL2Н4и т.д.) и соединения (H2O, NH2, CH
Примеры веществ с ковалентной связью
CO2HCl и т.д.). Соединения с донорно-акцепторными связями — катион аммония NH2+ катион аммония, тетрафторборанион BF2— и т.д. Полуполярные связанные соединения — оксид азота N3O, O-PCl4Кристаллы с ковалентной связью являются диэлектриками или полупроводниками. Алмаз, германий и кремний — типичные примеры атомных кристаллов (атомов, в которых атомы соединены между собой ковалентными (атомными) связями).2Определение ковалентной неполярной связи простое: это связь между двумя одинаковыми атомами. Пример образования неполярной ковалентной связи можно увидеть на диаграмме ниже.4Диаграмма ковалентной неполярной связи.4В молекулах с ковалентной неполярной связью общие электронные пары равноудалены от атомных ядер. Например, в молекуле кислорода (см. рисунок выше) атомы имеют восьмиэлектронную конфигурацию с четырьмя общими электронными парами.2Вещества с ковалентными неполярными связями обычно являются газами, жидкостями или относительно низкоплавкими твердыми веществами.3+ .
Давайте теперь ответим на вопрос, какая связь является ковалентно полярной. Таким образом, ковалентная полярная связь возникает, когда ковалентно связанные атомы имеют разные электроотрицательности и электроны связи не принадлежат в равной степени двум атомам. В большинстве случаев сталкивающиеся электроны находятся ближе к одному атому, чем к другому. Примером ковалентной полярной связи является связь, возникающая в молекуле хлористого водорода; там синтетические электроны, ответственные за образование ковалентной связи, находятся ближе к атому хлора, чем к атому водорода. Это связано с тем, что электроотрицательность хлора выше, чем у водорода.
Неполярная связь
Вот как выглядит ковалентная полярная связь.
Вода является типичным примером вещества с полярной ковалентной связью.
Ну, теперь вы знаете ответ на вопрос, как определить ковалентную полярную связь и неполярную связь; все, что вам нужно сделать, это знать свойства и химическую формулу молекулы; если эта молекула является ковалентной полярной связью, вы можете определить полярную связь.
Полярная связь