Какие частицы определяют заряд атомного ядра? Протоны! А число протонов соответствует (по значению) заряду атомного ядра, т.е. атомному номеру:
Строение атома
На что похож атом — на киевский торт или булочку с кишмишем? Мы рассмотрим атомную и молекулярную теорию, узнаем, почему японский физик сравнил атом с Сатурном, и закрепим наши знания мини-тестом в конце.
Еще в древние времена философы задавались вопросом, из чего состоит окружающая их природа. Демокрит был первым античным ученым, который предположил, что все в мире состоит из крошечных неделимых частиц. Он назвал эту частицу «атомом», что в переводе с греческого означает «неделимый».
К сожалению, возможности ученых в то время были очень ограничены. У них не было приборов для изучения структуры материи. Но значение Демокрита в возникновении атомизма не может быть вычеркнуто из истории.
Атомно-молекулярное учение. Строение атома
Пока в конце XIX века М.В. Ломоносов не ввел в химию количественные эксперименты, атомная теория оставалась лишь прерогативой философских теорий. Михаил Васильевич считал, что только знание законов физики может способствовать правильной интерпретации результатов химических экспериментов.
В своих исследованиях ученый различал в материи крупные частицы — «частицы» — и мелкие частицы — «элементы», или, как мы их называем сегодня, атомы.
Ломоносов считал, что каждая молекула идентична по составу всему веществу и что элементы с разной химической структурой имеют разный состав молекул. Ученый предположил, что вещества имеют особенности не только из-за различий в составе молекул, но и из-за разного расположения атомов в молекуле.
Следующий шаг в изучении атомов был сделан английским физиологом Джоном Дальтоном. Проводя различные эксперименты по растворению газов в жидкостях, ученый открыл самое важное физическое свойство атомов: эти крошечные частицы имеют вес. Но поскольку никто никогда раньше не видел атома, Дальтон описал вес частицы как относительный. Он обнаружил, что самым легким элементом является водород, и предложил принять его вес за единицу.
Открытие Дальтона стало большим прорывом в химии. На данный момент к любому химическому соединению можно было подойти с измерительным прибором. Это исследование приблизило нас к современной нотации химических формул и уравнений. И именно Дальтон придумал первые названия для известных химических элементов.
В конце 19 века, несмотря на усилия ученых, химическая структура атома все еще оставалась лишь предположением; ученым не хватало оборудования, чтобы понять тайну мельчайшей частицы.
Далтонс Эн
Протоны и нейтроны
Нагаока описал так называемую «краевую» модель личности в своем эссе. Он считал, что атом по своей структуре напоминает планету Сатурн. В его центре находится массивное ядро с положительным зарядом, а электроны с отрицательным зарядом движутся по орбитам вокруг ядра.
Нагаока использовал теорию Максвелла 1856 года о стабильности колец Сатурна для построения их атомной структуры. Японский ученый был убежден, что все фундаментальные свойства материи могут быть прояснены, если он будет основывать свои дальнейшие исследования на «сатурнианской» модели ядра.
Исследователь ошибся, но два постулата его теории были позже подтверждены:
Томсон предположил, что атом напоминает сферический, электрически нейтральный шар диаметром около 10-10 м, в котором положительный заряд равномерно распределен по всей структуре атома, а электроны хаотично расположены в этом поле. Поэтому можно сказать, что атом похож на маленькую булочку с султаном.
Эксперименты продолжались в нескольких странах. В лаборатории Резерфорда были проведены эксперименты, которые доказали, что в центре атома находится большое ядро диаметром окол о-10-15 м, которое содержит более 99,95% его массы и заряжено положительно.
- ядро атома имеет значительную массу;
- электростатические силы удерживают электроны на орбите (сходство с кольцами Сатурна, что удерживаются благодаря гравитационным силам).
Ученые продолжили свои исследования с помощью катодных лучей и обнаружили, что масса ядра примерно в два раза больше массы всех протонов в нем. Основываясь на этих результатах, Резерфорд выдвинул гипотезу о том, что в атомном ядре все еще существует тяжелая частица без заряда. Биографию этого выдающегося ученого можно кратко изложить в книге «Введение в топику физических наук» под редакцией А.Е. Гуревича.
В 1932 году Джеймс Чедвик открыл нейтрон — третий элемент, отсутствующий в атоме.
Атомные взаимодействия обеспечивают тесную связь между протонами и нейтронами в атомном ядре. Протоны и нейтроны имеют общее название — нуклоны. Ученые считают, что их характеристики достаточно схожи, чтобы поместить эти частицы в одно семейство, подобно тому, как биологи помещают собак и волков в один вид.
Казалось бы, загадка ядра раскрыта. Но нет, современная физика предполагает, что нуклоны состоят из еще более мелких частиц, кварков, и кварковая модель является основой современной науки.
Эксперименты по изучению атома и его ядра не прекращаются, и в 2010 году международная команда физиков, изучая протоны в ионном водороде, обнаружила, что радиус протона на 4% меньше, чем считалось ранее.
Таким образом, тайна радиуса протона вырвалась за пределы фундаментальной физики, поскольку измерение одной и той же величины в обычных и ионных
Интересный факт: Кварки имеют необычные названия — верхний, нижний, странный, истинный, очарованный и прекрасный. Частицы предпочтительно формируются из двух или трех кварков. В первом случае они называются мезонами, а во втором — барионами. Однако кварки никогда не появляются по отдельности.
Во Вселенной каждый объект состоит из чего-то. Предположим, что стул сделан из дерева и состоит из молекул. Молекулы состоят из атомов. Они имеют ядро с нейтронами и протонами внутри. Каждый слышал это на уроках физики. Протоны — это частицы с положительным зарядом. Нейтроны не имеют заряда. Вокруг ядра атома находится электрическое облако, в котором движутся электроны. Они также считаются отрицательно заряженными элементами. Количество протонов и электронов может варьироваться.
Что такое атом?
Каждая из этих микрочастиц считается универсальной. В мире не существует двух разных электронов, протонов или нейтронов. Они очень похожи. Свойства атома изменяются в зависимости от количества частиц в его составе.
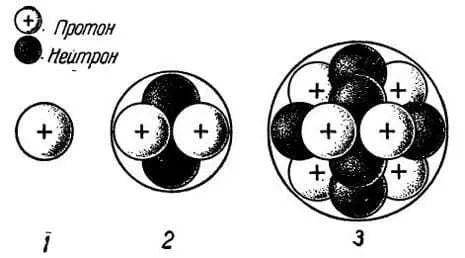
Предположим, что 1 атом водорода состоит из 1 электрона и 1 протона. Это самый простой элемент. Атом гелия имеет 2 нейтрона, 2 протона и 2 электрона. Его структура никогда не меняется. Атом лития состоит из 4 нейтронов, 3 протонов и 3 электронов. Существуют и другие вещества, которые ученые различают по их составу.
Атомы всегда группируются в молекулы, а те — в организмы, минералы. Поэтому все в этом мире состоит из мельчайших частиц. Допустим, молекула ДНК является основой всех живых организмов. Она сложна, но состоит из тех же основных элементов, что и неодушевленные предметы. Стоит отметить, что 99% всей плотной материи состоит из энергетических связей между этими частицами. Остальные 1% — это физические формы.
Строение атома
С течением времени было выдвинуто множество любопытных гипотез об атоме. Можно выделить некоторые из наиболее интересных.
Демокрит считал, что свойство предмета зависит от формы атома. Предположим, что жидкость состоит из гладких атомов. Это означает, что, по мнению древнегреческого философа, молоко и вода состоят из одинаковых частиц.
В 20 веке ученые предположили, что атом похож на планету. Это объясняется тем, что элемент, подобно Сатурну, имеет кольца вокруг своего ядра. Электроны движутся вокруг них. Хотя планета похожа на атомы, эта теория была опровергнута.
Интересно.
Что говорят учёные и древние мыслители об атоме
Модель Рутерфорда-Бора была признана наиболее точной. Ученый заявил, что атом похож на ядро, которое имеет положительный заряд и вокруг которого движутся атомы. Однако современные ученые обнаружили, что движение электронов хаотично и не имеет определенного направления.
Атом является основной единицей материи. Он состоит из протона, электрона и нейтрона. Они также состоят из кварков. Атом является частью молекулы, которая присутствует во всех окружающих предметах и в живых организмах. Ученые утверждают, что все в мире — это просто энергетическое состояние бесконечных полей, существующих в пространстве.
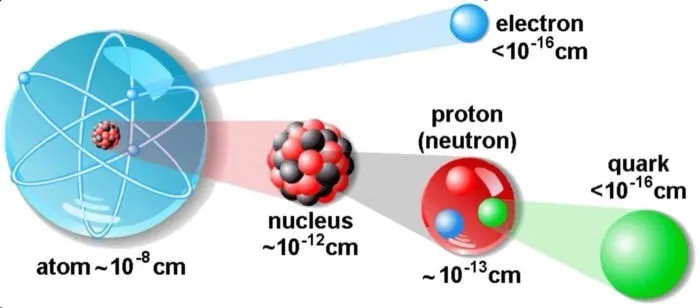
Проблема масштаба может быть решена с помощью более точного (хотя все еще несовершенного) представления (рис. 2).
Рисунок 2. Атом в основном пуст (серая область) и имеет быстро движущиеся электроны (синие точки, без масштаба, но гораздо больше). В центре находится тяжелое ядро (красная и белая точки, нарисованные в увеличенном масштабе).
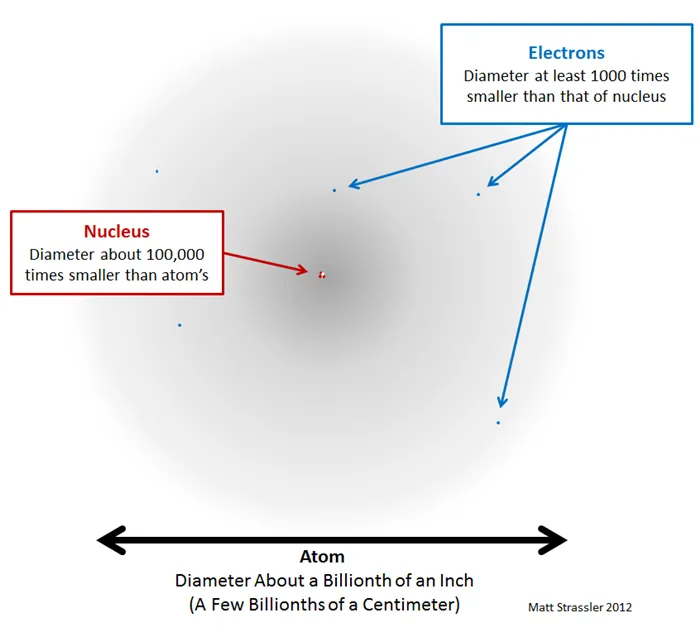
Вот что я хотел передать этой фотографией. Во-первых, электроны очень, очень малы, настолько малы, что мы никогда не могли измерить их размер — они могут быть точечными и малоразмерными, но они точно не больше 1/100 000 000 диаметра атома. Во-вторых, атомные ядра (и составляющие их протоны и нейтроны) также чрезвычайно малы, хотя они больше электронов. Их размер был измерен как примерно в 10 000 — 100 000 раз меньше диаметра атома. Атом немного похож на деревню. Протоны и нейтроны в ядре — это большие дома в центре деревни, а электроны — домики на окраине. Большая часть земли состоит из полей, а не домов. И хотя территория, которая считается частью деревни, может быть большой, площадь, на которой фактически стоят дома, очень мала.
Однако эта аналогия не является полной, поскольку в отличие от фермионов, электроны очень быстро перемещаются через серую область изображения и вокруг ядра, со скоростью около 1% от скорости света. Область, которую они покрывают, обычно не сферическая, а имеет более сложную форму, и, кроме того, не все электроны движутся в одной и той же области.
Но, как я вас предупреждал, рисунок 2 также неверен. Сначала нужно было бы нарисовать ядро в тысячу раз меньше, а электроны в миллион раз меньше, только тогда они не были бы видны. Если бы атом был размером с вашу спальню, то его ядро было бы размером с пылинку. По сравнению со своими составными частями, атомы огромны! В некотором смысле, большая часть атома пуста!
Более реалистичный атом
Во-вторых, картина не отражает темную природу квантовой механики. Уравнения квантовой механики описывают и предсказывают поведение молекул, атомов и субатомных частиц, и эти уравнения говорят нам, что эти частицы могут обладать очень странными и противоречивыми свойствами. Хотя электроны в некотором смысле точечные (например, если вы хотите столкнуть два электрона вместе, вы можете переместить их на любое расстояние друг от друга, не раскрывая их внутреннюю структуру, если она вообще существует), возможно, что, если оставить их в покое, они могут распространяться как волна и заполнить все серое пространство рисунка 2. Если это звучит странно, то не потому, что вы чего-то не понимаете, а потому, что это странно и трудно обдумать. Я, конечно, не знаю, как сделать
Небольшой размер ядра по сравнению с общим размером атома и тот факт, что оно обычно расположено в центре атома, объясняет, почему оно играет относительно слабую роль в химии. Химия происходит — то есть, молекулы образуются и изменяются — когда атомы приближаются друг к другу, и это происходит, когда внешние валентные электроны одного атома приближаются к внешним электронам другого атома — когда край серой области одного атома приближается к краю серой области другого атома. В химических процессах ядро остается в центрах атомов и никогда не приближается к другим ядрам. Основная роль ядра заключается в обеспечении положительного заряда, который удерживает электроны и большую часть массы (которая определяет, насколько трудно другим объектам сдвинуть атом).
Это ответ на вопрос 3: Химический состав атома в основном определяется деталями, связанными с его внешними электронами. Эти детали могут быть получены (сложным способом, через квантовомеханические уравнения) из атомного номера Z.
Вместо того чтобы заниматься химией — темой, которая могла бы стать предметом целого курса, — мы перейдем на более низкий уровень, к субатомным частицам, и по пути ответим на дополнительные вопросы. Давайте перечислим вопросы, с которыми мы столкнулись и которые еще предстоит исследовать.
1 Из чего состоят атомы? Электроны снаружи и атомное ядро (из протонов и нейтронов) в центре. 2 Каково значение атомного номера? Это число протонов в ядре атома, которое при нормальных условиях равно числу окружающих его электронов. 3. какова основная причина различий в химическом поведении атомов разных элементов? Свойства внешних электронов определяются общим числом электронов в каждом элементе, например, атомным номером. 4. в какой степени разные атомы одного и того же элемента похожи друг на друга? Мы обсудим это в статье об изотопах. 5. Как части атома удерживаются вместе? Обсудите это в статье о роли электрических сил и квантовой механики. 6. Почему атомы держатся вместе и образуют молекулы? Обсудите это в статье о роли электронов и электрических сил в образовании молекул из атомов.
Еще один вопрос, который может возникнуть при изучении рисунка 2:
Если атом в основном пуст, почему объекты кажутся твердыми? Почему невозможно проникнуть сквозь экран компьютера, если экран состоит из атомов, которые в основном пусты?
Как мы знаем, ядро атома не изменяется в ходе химических процессов. Но что меняется? Общее число электронов и распределение электронов. Общее число электронов легко определить.
Атом и его химия
Важно знать, что независимо от количества энергетических уровней, на внешнем (последнем) уровне не может быть более восьми электронов. Внешний энергетический уровень с восемью электронами является наиболее стабильным и называется закрытым уровнем. Наиболее неактивные элементы, благородные газы, имеют такие энергетические уровни.
Как определить количество электронов на внешнем энергетическом уровне других атомов? Для этого существует простое правило: число внешних электронов равно :
Задание 3.6 Определите число внешних электронов для химических элементов с атомными номерами 15, 25, 30, 53.
Задание 3.7 Найдите в периодической таблице химические элементы, атомы которых имеют полную внешнюю плоскость.
Очень важно правильно определить число внешних электронов, поскольку с ними связаны важнейшие свойства атома. Таким образом, в химических реакциях атомы пытаются «приобрести» стабильную, полную внешнюю плоскость (8 ē). Для этого атомы, имеющие всего несколько электронов во внешней плоскости, «предпочитают» покинуть ее.
Химические элементы, атомы которых могут отдавать только электроны, называются МЕТАЛЛАМИ. Очевидно, что внешний энергетический уровень атома металла должен иметь несколько электронов: 1, 2, 3.
Если на внешнем энергетическом уровне атома много электронов, то эти атомы склонны принимать электроны до тех пор, пока внешний энергетический уровень не заполнится, т.е. до восьми электронов. Такие элементы относятся к НЕМЕТАЛЛАМ.
Распределение электронов в поле ядра атома
Вопрос. К каким элементам (металлам или неметаллам) относятся химические элементы побочных подгрупп? Почему?
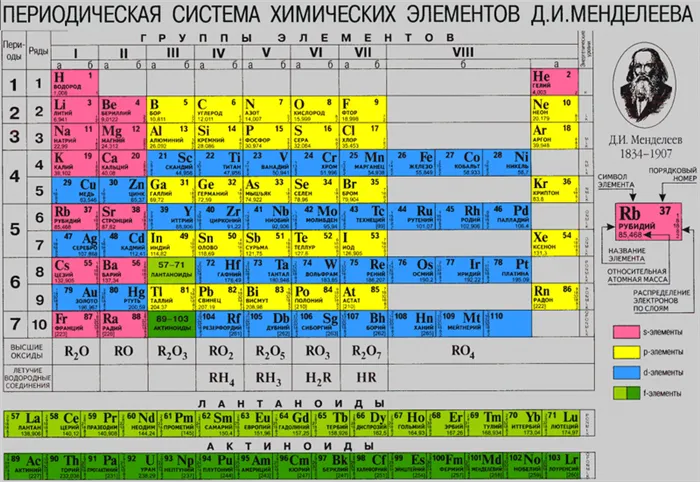
Металлы и неметаллы основных подгрупп таблицы Менделеева разделены линией, которую можно провести от бора до астатина. Выше этой линии (и на линии) находятся неметаллы, ниже — металлы.
Мы получили краткую электронную формулу для атома марганца, которая отражает распределение его валентных электронов. Что мы можем вывести из этой формулы?
Какие свойства, металлические или неметаллические, преобладают у этого элемента? Ответ: Марганец является металлом, так как имеет 2 электрона во внешней (четвертой) плоскости.

2. какой процесс характерен для металла? Ответ: Отдаются только электроны.
3. Какие и сколько электронов отдает атом марганца? Реакция:
- на первом энергетическом уровне не более 2 электронов;
- на втором энергетическом уровне не более 8 электронов;
- на третьем энергетическом уровне не более 18 электронов.
Все эти соображения и выводы можно проиллюстрировать с помощью диаграммы (рис. 12).
Полученные условные заряды атома называются состоянием окисления.
Если посмотреть на структуру атомов кислорода и водорода и рассуждать аналогичным образом, то можно показать, что типичными состояниями окисления являютс я-2 для кислорода и +1 для водорода.
Вопрос. С каким из этих химических элементов можно сравнить марганец?
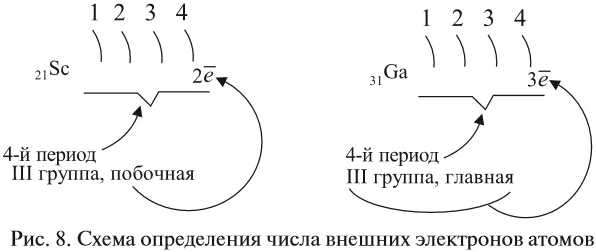
- для элементов главных подгрупп — номеру группы;
- для элементов побочных подгрупп — оно не может быть больше двух (рис. 8).
Чтобы понять все эти понятия, давайте рассмотрим структуру атома теллура и некоторые его свойства (см. рис. 13). Этот рисунок показывает, что теллур относится к неметаллам, поскольку, во-первых, он имеет шесть электронов во внешней плоскости и, во-вторых, его символ находится в главной подгруппе над линией B-At. В отличие от металлов, неметаллический теллур может иметь более низкую степень окисления ( -2 ) и образовывать летучие водородно-водородные соединения ( H
Высшее состояние окисления атома теллура ( +6 ) соответствует номеру группы, и в этом состоянии окисления теллур образует высший TeO
Задание 3.11. Нарисуйте электронные конфигурации атомов Nа, Rb, СІ, СІ, I, Si, Sn. Определите свойства химических элементов, типы их простейших соединений (с кислородом и водородом).
Размер атомов чрезвычайно мал. Самый маленький атом — это атом гелия с радиусом 32 пикометра. Самый большой атом — атом цезия с радиусом 225 пикометров. Приставка пико означает десять в степени минус двенадцать! Это означает, что если уменьшить 32 метра в тысячу миллиардов раз, то получится размер радиуса атома гелия.
В этом случае масштаб вещей таков, что атом на самом деле на 99% состоит из вакуума. Ядро и электроны занимают лишь очень малую часть объема. Чтобы понять это, рассмотрим следующий пример. Если представить атом в форме Олимпийского стадиона в Пекине (или, если вы не можете представить Пекин, просто представьте большой стадион), то ядром этого атома будет вишневое дерево в центре стадиона. Орбиты электронов находились бы на высоте верхних трибун, а вес вишни составил бы 30 миллионов тонн. Впечатляет, не правда ли?
Как вы знаете, различные атомы теперь сгруппированы на доске Менделеева. Существует 118 (а если считать предсказанные, но еще не открытые элементы — 126) элементов, не считая изотопов. Однако так было не всегда.
В начале формирования Вселенной вообще не было атомов, только элементарные частицы, взаимодействующие под воздействием огромных температур. Как сказал бы поэт, это был настоящий апофеоз частиц. В первые три минуты существования Вселенной из-за падения температуры и совпадения многих других факторов начался процесс первичного зарождения, в ходе которого из элементарных частиц образовались первые элементы — водород, гелий, литий и дейтерий (тяжелый водород). Первые звезды образовались из этих элементов в результате термоядерных реакций в недрах звезды с образованием водорода, водорода, водорода и гелия.
Строение атома и свойства элементов
- два внешних электрона (они дальше всех от ядра и слабее притягиваются им);
- семь (2+5) валентных электронов (так как в этом случае на третьем уровне атома останется восемь электронов, т. е. образуется завершённый уже внешний уровень ).

2О7
23.

- В химических реакциях участвуют только валентные электроны, которые могут находиться только на последних двух уровнях.
- Атомы металлов могут только отдавать эти электроны (все или несколько), принимая положительные степени окисления.
- Атомы неметаллов могут принимать (недостающие до восьми) электроны, получая при этом отрицательные степени окисления, и отдавать валентные электроны (все или несколько), принимая при этом положительные степени окисления.
Размер

Откуда взялись атомы?

Почему ядро атома не распадается?