Углекислый газ является первоклассной средой для размножения цветов, питания овощей и подводных растений. Он ускоряет фотосинтез и улучшает обменные процессы в клетках растений. Но самое главное, что цена разумная — даже для обычных пользователей.
Углекислый газ в промышленности, его получение и применение

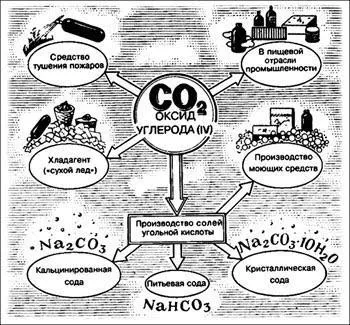
Благодаря своим универсальным свойствам углекислый газ используется в промышленности, медицине и сельском хозяйстве. Сегодня CO2 является удобрением в сельском хозяйстве, медицинским средством, регулятором температуры и источником новой энергии.
- 1 Получение в промышленности
- 1.1 Получение газообразной двуокиси углерода
- 1.2 Получение жидкой углекислоты
- 1.3 Получение твердого диоксида углерода
- 2.1 Химическая промышленность:
- 2.2 Металлургия:
- 2.3 Производство бумаги:
Получение в промышленности
Производство углекислого газа в промышленности методически разнообразно. Он содержится в выхлопных газах теплоэлектростанций, образуется при ферментации спирта и является продуктом реакции с природными карбонатами.

Промышленность по производству двуокиси углерода является крупномасштабной. Газ может быть поглощен из источника несколькими способами. Во всех случаях это поэтапный процесс удаления примесей (для соответствия требованиям ГОСТа) и достижения желаемой консистенции, агрегатного состояния.
Получение газообразной двуокиси углерода
Газообразный CO2 извлекается из промышленных отходов (нефти) путем адсорбции с помощью моноэтаноламина (коммерчески выгодно) и карбоната калия (редко). Принцип разделения частиц углерода одинаков для обоих веществ. Они подаются по трубопроводу к отходам и собирают углекислый газ. После сбора газы, насыщенные углекислым газом, отправляются на очистку.
Реакция происходит в специальных емкостях при повышенной температуре или пониженном давлении. В ходе этого процесса выделяется чистый углекислый газ и продукты разложения (аммиак и другие).

Схематично процесс выглядит следующим образом:
- Отходящий дым смешивается с адсорбентами (газообразным карбонатом калия или моноэтаноламином);
- Накопившие в себе двуокись углерода газы поступают в специальный газгольдер для очистки;
- В реакции с высокой температурой или низким давлением происходит отделение углекислого газа от адсорбента.
В лабораторных условиях невозможно получить большое количество CO2. Однако возможна реакция с углеводородами и кислотами. Кроме того, CO2 может быть получен на промышленных предприятиях для производства кислорода, аргона или азота. Побочным продуктом этого процесса является двуокись углерода. Он хранится в специальных баллонах, которые доставляются потребителю.
Получение жидкой углекислоты
Добыча жидкого диоксида углерода шаг за шагом связана с добычей диоксида углерода из газа. Летучее газообразное состояние, обработанное водородом, раствором перманганата калия и углеродом, превращается в жидкий диоксид углерода.
Разжижение происходит из-за отрицательного давления, связанного с реакцией. После многоступенчатой очистки жидкий диоксид углерода поступает в компрессор. Там он сжимается и подается на сушку в 2 адсорбера, которые поочередно берут на себя задачу восстановления. В то же время сжатая жидкость очищается от запахов и транспортируется в конденсатор, а оттуда — на хранение.
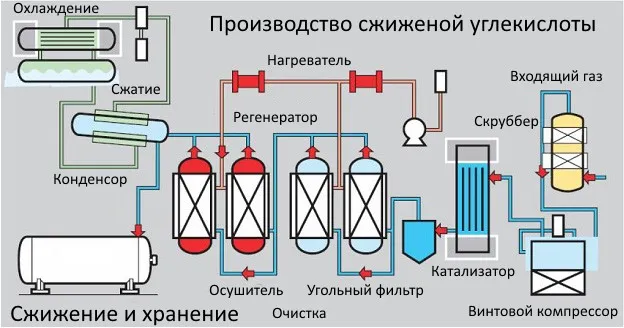
Этот метод сжижения используется для газов спиртового брожения. Это пропан, бутан и т.д. Он используется на крупных пивоваренных заводах и
Получение твердого диоксида углерода
По различным оценкам, мировое потребление CO2 составляет более 20 миллионов тонн в год. На такой высокий уровень потребления влияют потребности пищевой и нефтяной промышленности, технологии газирования напитков и другие промышленные нужды, такие как снижение Ph водоочистных установок, металлургические проблемы (включая использование сварочного газа) и т.д.

Применение в промышленности
Применение двуокиси углерода постоянно растет, так как расширяются области ее использования: в промышленности — для консервирования продуктов питания, в машиностроении — от производства сварных швов и приготовления сварочных защитных смесей до очистки поверхностей деталей гранулами «сухого льда», в сельском хозяйстве — для питания сельскохозяйственных культур, в газовой и нефтяной промышленности — для пожаротушения.

Химическая промышленность:
- Участвует в синтезе искусственных химикатов;
- Регулирует температуру в реакциях;
- Нейтрализует щелочи;
- Очищает ткани животных и растений;
- Может восстанавливаться до метана.
Металлургия:
- Осаждение отходящего дыма;
- Регулирует направления течения воды при отводе шахт;
- Некоторые лазеры используют CO2 в качестве источника энергии (неон).
Производство бумаги:
- Регулирует водородный показатель в древесной массе или целлюлозе;
- Усиливает в мощности производственные машины.
Газирование напитков может осуществляться двумя способами:
- Источник охлаждения в морозильных камерах при перевозках;
- Охлаждение при затвердевании сплавов;
- Очистка сухим льдом оборудования (криобластинг).
С 1960 года сварка легированных и карбонизированных сталей в углекислом газе (CO
), который соответствует требованиям ГОСТ 8050. В последнее время сварочные газовые смеси аргона и гелия стали более распространенными в сварочных технологиях машиностроительных компаний, и многие из наиболее распространенных газовых смесей содержат небольшое количество активного газа (CO
- в машиностроении и строительстве (для сварки и прочее);
- для холодной посадки частей машин;
- в процессах тонкой заточки;
- для электросварки, основанной на принципе защиты расплавленного металла от вредного воздействия атмосферного воздуха;
- в металлургии;
- продувка углекислым газом литейных форм;
- при производстве алюминия и других легкоокисляющихся металлов;
- в сельском хозяйстве для создания искусственного дождя;
- в экологии заменяет сильнодействующие минеральные кислоты для нейтрализации щелочной отбросной воды;
- в изготовлении противопожарных средств;
- применяется в углекислотных огнетушителях в качестве огнетушащего вещества, эффективно останавливает процесс горения;
- в парфюмерии при изготовлении духов;
- в горнодобывающей промышленности;
- при методе беспламенного взрыва горных пород;
- в пищевой промышленности;
- используется как консервант и обозначается на упаковке кодом Е290;
- в качестве разрыхлителя теста;
- для производства газированных напитков;

Напитки с углекислотой
или O
- При производстве популярных сладких и минеральных вод используется механический способ газирования, который предполагает насыщение углекислым газом какой-либо жидкости. Для этого необходимо специальное оборудование (сифоны, акратофоры, сатураторы) и баллоны со сжатым углекислым газом.
- При химическом способе газирования углекислоту получают в процессе брожения. Таким образом получается шампанское вино, пиво, хлебный квас. Углекислота в содовых водах получается в результате реакции соды с кислотой, сопровождающейся бурным выделением углекислого газа.

СО2как сварочный газ
), который необходим для стабилизации сварочной дуги. Однако при сварке углеродистых и низколегированных сталей основных строительных категорий на российских предприятиях в качестве защитного газа по-прежнему используется в основном углекислый газ CO2из-за физических свойств этого защитного газа и его доступности.2Для получения цен на газ или дополнительных консультаций звоните по телефону +7 (495) 545-44-62 или отправьте нам запрос.2Диоксид углерода — это бесцветный газ с едва уловимым запахом. Он не ядовит, он тяжелее воздуха. Углекислый газ широко распространен в природе. Он растворяется в воде и образует углекислый газ H2что вызывает кислый вкус воды. Воздух содержит около 0,03 % углекислого газа. Его плотность в 1,524 раза больше плотности воздуха, т.е. 0,001976 г/см3 (при нулевой температуре и давлении 101,3 кПа). Потенциал ионизации составляет 14,3 В. Химическая формула: CO
Откуда у этого газа появилось столько названий, неизвестно, но при изготовлении сварных швов используется термин «углекислый газ» в соответствии с ГОСТ 2601. Термин «углекислый газ» принят в «Правилах устройства и безопасной эксплуатации сосудов, работающих под давлением», а термин «двуокись углерода» — в ГОСТ 8050. Поэтому в дальнейшем мы будем ссылаться на все эти термины.
Углекислый газ, он же углекислота, он же двуокись углерода…

Плотность углекислого газа зависит от давления, температуры и агрегатного состояния, в котором он находится. При атмосферном давлении и температур е-78,5 °C двуокись углерода переходит в жидкую фазу углекислого газа.2CO3Удельный вес жидкой двуокиси углерода значительно изменяется в зависимости от температуры, поэтому количество двуокиси углерода определяется и продается по массе. Растворимость воды в жидком диоксиде углерода в диапазоне температур 5,8-22,9°C составляет не более 0,05%.2.
Содержание
- Жидкая углекислота
- Сухой лед
- История открытия
- Способы получения
- Применение
- Применение углекислого газа для сварки
- Коэффициенты перевода объема и массы CO2при Т=15°С и Р=0,1 МПа
- Коэффициенты перевода объема и массы CO2при Т=0°С и Р=0,1 МПа
- Углекислота в баллоне
Жидкий углекислый газ при нагревании превращается в газ.
При нормальных условиях (20°C и 101,3 кПа) при испарении 1 кг жидкого углекислого газа образуется 509 л углекислого газа.
Жидкий диоксид углерода впервые был получен Хамфри Дэви и Майклом Фарадеем в 1823 году.
Твердый диоксид углерода (сухой лед) внешне похож на снег и лед. Содержание углекислого газа в брикетах сухого льда высокое — 99,93-99,99%. Содержание влаги варьируется в пределах 0,06-0,13%. Сухой лед легко испаряется на открытом воздухе, поэтому для хранения и транспортировки используются контейнеры. Углекислый газ извлекается из сухого льда в специальных испарителях. Твердая двуокись углерода (сухой лед), поставляемая в соответствии с ГОСТ 12162.
Жидкая двуокись углерода
Если газ извлекается слишком быстро, давление в баллоне падает, тепла поступает недостаточно, углекислый газ охлаждается, скорость его испарения падает, и, достигнув «тройной точки», он превращается в сухой лед, который закупоривает отверстие редуктора и прекращает дальнейшее извлечение газа. При нагревании сухой лед превращается непосредственно в углекислый газ, минуя жидкое состояние. Для испарения сухого льда требуется гораздо больше тепла, чем для испарения жидкой двуокиси углерода, поэтому сухой лед испаряется в бутылке медленно.
Углекислый газ — это первый газ, который был описан как самостоятельное вещество. В 19 веке фламандский химик Ян Баптист ван Гельмонт заметил, что после сжигания угля в герметичном контейнере масса золы была намного меньше массы угля. Он объяснил это тем, что углерод превратился в невидимую массу, которую он назвал «газом».
Свойства углекислого газа были открыты гораздо позже, в 1750 году, шотландским физиком Джозефом Блэком.
Он обнаружил, что известняк (карбонат кальция CaCO
) при нагревании или реакции с кислотами выделял газ, который он назвал «связанным воздухом». Оказалось, что «связанный воздух» плотнее воздуха и не поддерживает горение.
Сухой лед
Прохождение «связанного воздуха», т.е. углекислого газа CO
через водный раствор извести Ca(OH)
История открытия углекислого газа
карбонат кальция CaCO
Джозеф Блэк использовал этот эксперимент, чтобы показать, что при дыхании животных выделяется углекислый газ.
Диоксид углерода нетоксичен и невзрывоопасен. При концентрации выше 5 % (92 г/м3 ) углекислый газ вреден для здоровья, так как он тяжелее воздуха и вблизи земли может превращаться в3Углекислый газ транспортируется и хранится в стальных баллонах по ГОСТ 949 или в резервуарах большой емкости в жидком состоянии с последующей газификацией на заводе, при этом к сварочным постам подается централизованно по рампам.
25 кг жидкого углекислого газа заливаются в стандартную бутылку емкостью 40 литров воды. Эта жидкая двуокись углерода занимает 67,5 % объема бутылки при нормальном давлении и при испарении выделяет 12,5 м 3 двуокиси углерода.2Воздух собирается вместе с углекислым газом в верхней части цилиндра. Вода, которая тяжелее жидкого углекислого газа, собирается на дне цилиндра.2Чтобы уменьшить содержание влаги в углекислом газе, рекомендуется поместить баллон с закрытым вентилем и дать ему постоять в течение 10 — 15 минут. Осторожно откройте клапан и дайте влаге выйти из баллона. Перед сваркой следует выпустить небольшое количество газа, чтобы удалить воздух, застрявший в баллоне. Часть влаги будет задержана в углекислом газе в виде водяного пара и ухудшит качество сварного шва.3.
Когда газ выходит из баллона, он значительно охлаждается из-за эффекта удушья и поглощения тепла, вызванного испарением жидкого углекислого газа. Сильный отбор газа может привести к засорению редуктора давления замерзшей влагой, содержащейся в углекислом газе и сухом льде. Для предотвращения этого необходимо установить газовый нагреватель перед редуктором давления во время отбора углекислого газа. Окончательное удаление влаги после восстановителя осуществляется с помощью специальной сушилки, заполненной стекловатой и хлоридом кальция, силикогелем, сульфатом меди или другими поглотителями влаги.
Цилиндр окрашен в черный цвет и имеет желтую надпись «HYDROCARBON WASTE».
Основными антропогенными источниками углекислого газа являются:
Хотя доля экологически чистых автомобилей растет во всем мире, подавляющее большинство населения планеты не сможет (или не захочет) перейти на новые автомобили.
Активная вырубка лесов в промышленных целях также увеличивает концентрацию CO2 в воздухе.
CO2 является одним из конечных продуктов метаболизма (расщепление глюкозы и жира). Он высвобождается в тканях и переносится гемоглобином в легкие, через которые он выдыхается. Выдыхаемый человеком воздух содержит около 4,5 % углекислого газа (45 000 ppm) — в 60-110 раз больше, чем вдыхаемый.
Углекислый газ играет важную роль в регуляции кровоснабжения и дыхания. Увеличение содержания CO2 в крови вызывает расширение капилляров, что позволяет крови течь быстрее, доставляя кислород к тканям и удаляя углекислый газ.
Сайт
Углекислый газ участвует во всех глобальных процессах газообмена в атмосфере, почвах и водосборных бассейнах. Он входит в состав всех живых организмов, а для большинства организмов и растений является важным функциональным компонентом дыхания как жизненно важного процесса.
Искусственные источники углекислого газа
Люди используют углекислый газ для различных целей, особенно в качестве защитного агента при сварке.
- промышленные выбросы, связанные с процессами сгорания;
- автомобильный транспорт.
Углекислый газ содержится в атмосфере в количестве до 0,045 %, что эквивалентно примерно 800 миллиардам тонн только в виде газа. В воде и почве он еще выше.
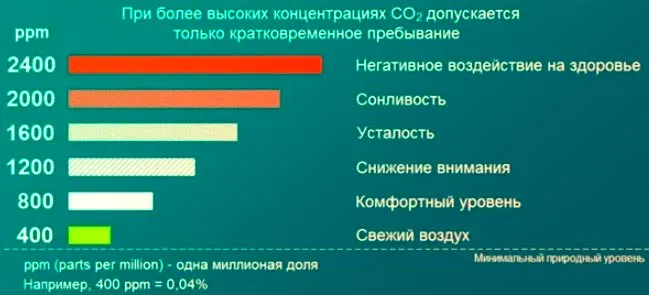
Сегодня он составляет порядка 400 ppm (400 частей на миллион). Для сравнения, 300-350 лет назад, до Великой промышленной революции, когда в XVII веке началась радикальная трансформация мировой экономики в сторону индустриализации, этот параметр составлял около 250 промилле.
Углекислый газ в организме человека
Интересно, что в черте города этот показатель достигает 450-470 промилле, а в общественных местах, таких как школы, — 1000-1200 промилле и более. Это свидетельствует о негативных последствиях дорожного движения и перенаселенности.
Несмотря на свое небольшое количество, CO2 играет важную роль в биосфере и экологии. Наиболее важной формой воздействия является воздействие парникового газа:
По оценкам ученых, без него среднегодовая температура поверхности планеты была бы на 25-30 °C ниже.
Что такое углекислый газ
В закрытых помещениях основным источником CO2 является человек. Каждый час взрослый человек выдыхает до 20 литров (0,5 кубического метра) газа в состоянии покоя и до 35-40 литров во время энергичной физической активности.
В зависимости от характера помещения, дополнительный углекислый газ может вырабатываться газовым котлом и кухней.
Средняя допустимая плотность углекислого газа в помещении составляет 600 ppm, поэтому необходимо регулярно проветривать все жилые и технические помещения, активировать соответствующие системы вентиляции или просто открывать окна на короткое время.
Углекислый газ примерно в полтора раза тяжелее свежего воздуха и поэтому накапливается в подземных и наземных помещениях.
Углекислый газ в атмосфере
Свойства углекислого газа таковы, что его запах невозможно почувствовать при нормальных условиях. Ощущения запаха и вкуса возникают только при повышенных концентрациях — кислый вкус во рту, вызванный образованием небольшого количества углекислого газа под воздействием влаги слизистой оболочки.
Растворимость углекислого газа в воде и сиропе используется в пищевой промышленности для производства различных напитков.
Газ не участвует в горении, что, естественно, привело к его использованию в современных огнетушителях (например, углекислотных). Токсичность отсутствует, другие свойства с точки зрения безопасности для человека должны быть тщательно оценены.

Самый важный
- газ препятствует выходу инфракрасного излучения с планеты в окружающее пространство;
- температура атмосферы год за годом увеличивается;
- происходят изменения природных явлений и климата;
- текущий формат этих преобразований – ускоренное таяние ледниковых «шапок», повышение уровня Мирового океана и изменения в составе биосферы.
Углекислый газ в помещении
Свойства углекислого газа
Физические свойства
- превалирующее природное агрегатное состояние: газообразное;
- возможное изменение: переход в твёрдое кристаллообразное состояние (так называемый «сухой лёд») при охлаждении до минус 78°С или жидкое состояние при давлении около 60 атмосфер;
- особые признаки по вкусу и запаху в нормальном состоянии: отсутствуют;
- восприимчивость к электричеству: проводником не является, при образовании тлеющего разряда излучает светло-зелёное свечение;
- плотность: около 1,97 грамм на литр;
- растворимость в органических веществах: частичная;
- способность к горению: отсутствует, в его окружении горят редкоземельные и щелочные металлы.
Химические свойства
- тип вещества: оксид кислотного класса (способен образовать угольную кислоту при наличии воды);
- термическое разложение: да, на кислород (О) и угарный газ (СО);
- химическая активность: взаимодействие с основаниями и оксидами активных металлов, с простыми веществами – при наличии катализатора;
- обнаружение: при прохождении СО2 через воду с лакмусом изменяет цвет в сторону красных оттенков, а известковая вода (растворенный гидроксид кальция) помутнеет;
- отношение к горению: вытеснение кислорода и остановка тления.

- перевозка и хранение различных пищевых продуктов (полуфабрикаты, мясо, рыба), при этом наблюдается отсутствие появления плесени и гнили органики;
- внесение в напитки для придания им полезных свойств – отмечается благоприятное действие на организм газированной минеральной или сладкой воды;
- создание пищевых добавок для повышения сроков и условий хранения пищевых продуктов (к примеру, разрыхлитель Е290);
- изготовление кофе без кофеина (участвует в технологическом процессе удаления растворенного вещества);
- организация целебных ванн с углекислотой для поддержания и восстановления здоровья сердечно-сосудистой системы;
- целый спектр специализированных задач в медицине – к примеру, работа с образованиями в тканях, стимуляция дыхания;
- проверка морозоустойчивости резинотехнических изделий (в частности – автомобильные покрышки, которые испытываются с сухим льдом);
- испытания различного оборудования, механизмов и инструментов на предмет пониженных температур;
- изготовление и перезаправка углекислотных огнетушителей (наиболее эффективное средство тушения огня на электрооборудовании и горючих жидкостях);
- рабочая среда в пневматическом оружии;
- применение в качестве реагента для химических реакций с целью синтеза и производства солей, полимеров и различных волокон;
- очистка сточных вод от загрязнений;
- защита расплавленного металла сварочной ванны.