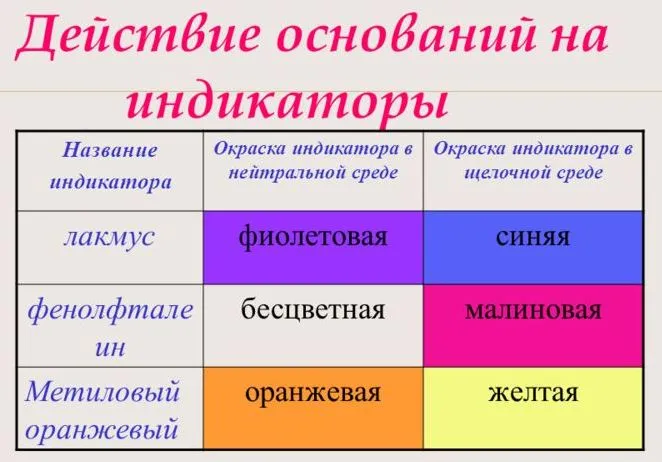
Наиболее распространенными маркерами являются литий, метиловый оранжевый и фенолфталеин. В нейтральной среде литмос — фиолетовый, метиловый оранжевый и фенолфталеин — бесцветный.
Что такое основание в химии
Основания или гидроксиды — это соединения металлов, содержащие OH-гидроксильные группы (одна или более OH-групп на каждый атом металла M, т.е. MON или M(OH).n). OH-гидроксильная группа является ионом, ее заряд равен 1-, а валентность — I.
Название основания состоит из двух слов: KOH означает гидроксид калия. Если металл имеет переменную валентность, это обозначается римской цифрой в скобках: Cr(OH)3— гидроксид хрома(III).
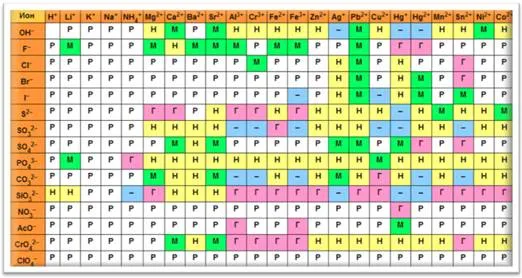
Чтобы составить формулу гидроксида из названия соединения, необходимо знать заряд катиона металла M n +. Количество гидроксильных групп в формуле равно величине этого заряда: M(OH)n. Заряды катионов металлов можно взять из таблицы растворимости.
В гидроксиде калия, например, заряд иона калия равен 1 +, K +, поэтому формула — KON. В гидроксиде бария ион бария — Ba 2+, формула — Ba(OH).2.
Щелочи — это растворимые в воде основания (LiOH, NaOH, KOH, Ba(OH)2Ca(OH)2Щелочи очень едкие и вызывают ожоги. При работе с ними необходимо обращать особое внимание на правила техники безопасности и надевать защитные очки и перчатки.
Щелочные растворы определяются с помощью индикаторов.

Это органические пигменты, которые меняют цвет в зависимости от состава раствора. Например, бесцветный раствор фенолфталеина в щелочном растворе становится малиновым. Фиолетовый раствор лития становится синим в щелочных растворах, а оранжевый раствор метилового оранжевого становится ярко-желтым.
Нерастворимые основания — это вещества, которые практически не растворяются в воде, например, гидроксид железа(III), гидроксид меди(II), гидроксид магния.
Основные оксиды — это оксиды, которым соответствуют основания. Если элемент образует несколько оксидов, то оксид с наименьшей степенью окисления является основным оксидом. CrO и MnO, например, являются основными оксидами.
Основные оксиды получаются путем вычитания необходимого количества молекул воды из основной формулы. Например, для основных оксидов Na2O, CaO, Fe2O3(a) 2NaOH — H2O = Na2O; (b) Ca(OH)2– Н2O = CaO- (c) 2Fe(OH)3— 3Н2O = Fe2O3.

Получение оснований
Растворимые основания получают путем:
(α) реакция щелочных оксидов и щелочноземельных металлов с водой: BaO + H2O = Ba(OH)2 ,
(b) Взаимодействие активных металлов (электроотрицательность 1,2 или меньше) с водой: 2 Li + 2H2O = 2LiOH + H2↑ ;
(c) электролиз водного раствора соли, например, хлорида натрия; когда раствор подвергается воздействию постоянного электрического тока, водород выделяется на катоде, а хлор на аноде, оставляя гидроксид натрия в растворе: 2NaCl + 2H2O →Электролиз→ H2↑ + 2NaOH + Cl2↑.
Нерастворимые основания получаются в результате реакции обмена растворимых солей на щелочи: CuCl2+ 2NaOH = Cu(OH)2CuOH (CuOH) ↓ + 2NaCl.
Химические свойства оснований
Нерастворимые основания являются довольно нестабильными соединениями. При нагревании (300-400°C) вода теряется. Например, синий гидроксид меди(II) при нагревании разлагается на воду и превращается в черный оксид меди(II): Cu(OH)2→ t → CuO + H2O.


Обзор курса «Основы».
Урок 37. Основания
В уроке 37 «Основания» из курса «Химия для чайников» вы узнаете о составе оснований, выясните, к каким типам они относятся, и рассмотрите, с какими веществами взаимодействуют эти сложные вещества.

Существует целый класс сложных неорганических веществ, включающий атомы металлов и OH-группы. Все вещества этого класса реагируют с кислотами с образованием солей, т.е. являются, так сказать, «основанием» солей. Поэтому этот класс веществ называется основаниями.
- Состав оснований
- Классификация оснований
- Химические свойства оснований
- Изменение окраски индикаторов
- Взаимодействие с кислотами
- Взаимодействие с кислотными оксидами
- Взаимодействие с солями
- Термическое разложение
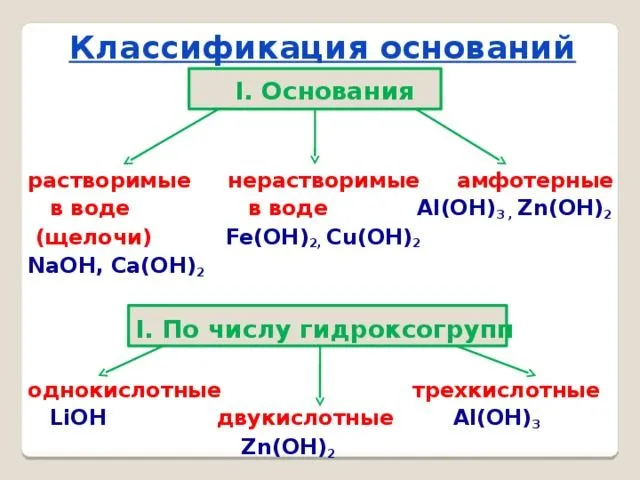
Классификация оснований
Основания делятся на растворимые и нерастворимые в зависимости от их растворимости в воде. Растворимые основания включают NaOH, KOH, Ba(OH)2 и Ca(OH)2. Их общее название — щелочи. При нормальных условиях они представляют собой белые твердые вещества. Основания Mg(OH)2, Al(OH)3), Zn(OH)2Fe(OH)2Fe(OH)3и некоторые другие. Они также представляют собой твердые тела, многие из которых окрашены в разные цвета (рис. 120).

Примечания: Термин «щелочь» происходит от древнерусского слова «щелок», что означает отвар чего-либо в воде. Это слово использовалось, например, для описания жидкости, получаемой при кипячении смеси воды и растительной золы. Зольное вещество реагирует с водой, образуя гидроксид калия KOH. Это соединение, содержащееся в щелочи, получило название «щелок». Позже этот термин был применен ко всем растворимым основаниям.
Виды
Базы классифицируются двумя способами:
- по количеству групп ОН – однокислотные и многокислотные;
- по растворимости в воде – щёлочи (растворимые) и нерастворимые.
Щелочи образуются из щелочных металлов лития (Li), натрия (Na), калия (K), рубидия (Rb) и цезия (Cs).
Кроме того, щелочноземельные металлы кальций (Ca), стронций (Sr) и барий (Ba) являются активными щелочеобразующими металлами. Эти элементы образуют следующие основы:
Все другие основания, например, Mg(OH)2, Cu(OH)2, Al(OH)3В противном случае щелочи называются сильными основаниями, а нерастворимые основания — слабыми основаниями. Щелочи быстро отдают гидроксильную группу при электролитическом разложении и реагируют с другими веществами. Нерастворимые или слабые основания менее активны, так как они не связывают гидроксильную группу.
Амфотерные гидроксиды занимают особое положение в систематике неорганических веществ. Они реагируют с кислотами и основаниями, т.е. в зависимости от условий могут вести себя либо как основания, либо как кислоты. К ним относятся Zn(OH)
, Al(OH)2, Al(OH)3, Cr(OH)2Be(OH)3и другие базы.2Основные химические свойства оснований описаны в таблице.
Химические свойства
Реакции
Что образуется
Примеры
Соль и вода. Нерастворимые основания реагируют только с растворимыми кислотами.
Разложение при высокой температуре
Оксид металла и вода
с кислотными оксидами (реагирует со щелочами)
с неметаллами (реагирует со щелочами)
Обмен с солями
Гидроксид и соль
Щелочи с некоторыми металлами
Комплексная соль и водород
Для определения категории почвы проводится тест с использованием индикатора. При взаимодействии с основанием литий становится синим, фенолфталеин — малиновым, а метиловый оранжевый — желтым.
В этом видеоролике студенты знакомятся с классом соединений, называемых основаниями. В нем объясняется состав оснований, правила наименования, классификация и свойства наиболее распространенных оснований, как использовать таблицу растворимости для определения растворимости оснований в воде и, что наиболее интересно для студентов, анимация изменения цвета маркеров в щелочных растворах.
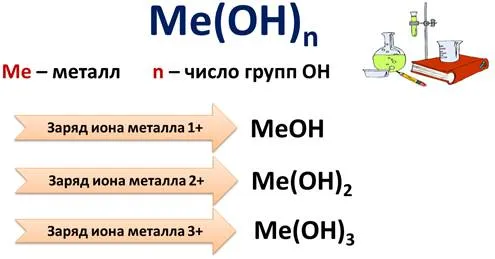
Основания

где Me — металл, а n — количество OH-групп.

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Если заряд иона металла 1+, то с ионом металла связана 1 группа OH, формула этих оснований — MeOH, а если заряд иона металла 2+, то с ионом металла связаны 2 группы OH, формула этих оснований — Me(OH).

и т.д.
3. Смотрите статистику просмотра видеоуроков учениками.Конспект урока «Основания»
Название оснований состоит из слова гидроксид + название металла в общем случае. Например, КОН — гидроксид калия, Ba(OH)
— Гидроксид бария, Al ( OH )
— гидроксид алюминия .
Если металл имеет переменную степень окисления, то числовое значение степени окисления приводится в скобках римскими цифрами после названия. Например: Cu ( OH )
— Гидроксид меди (II), Fe (OH)
— Гидроксид железа (III), Mn (OH)
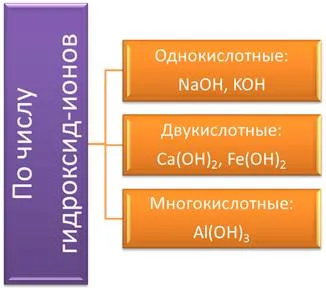
— Гидроксид марганца ( II ) .nОснования подразделяются в зависимости от количества гидроксид-ионов на: 1-кислотные основания с 1 гидроксид-ионом в формуле (NaOH, KOH ), 2-кислотные основания с 2 гидроксид-ионами в формуле (Ca(OH )
Fe(OH); многокислотные основания с тремя и более гидроксид-ионами (Al(OH)).2В зависимости от растворимости в воде основания делятся на водорастворимые или щелочные и нерастворимые в воде. Растворимые основания — это основания, образованные из металлов группы I A и некоторых металлов группы II A, например, NaOH, Ba (OH).
KOH. Водорастворимые основания хорошо растворяются в воде и не образуют осадка, а нерастворимые основания, наоборот, образуют осадок и не растворимы в воде. Например, Cu ( OH )2Al ( OH )3Fe ( OH ), Fe ( OH ) .
Чтобы определить, является ли основание водорастворимым или нерастворимым, можно воспользоваться таблицей растворимости. Если пересечение иона металла и гидроксид-иона в таблице показывает P, это означает, что основание растворимо в воде, если пересекается с «M», это означает, что основание мало растворимо в воде, а если пересекается с «H», это означает, что основание не растворимо в воде. означает, что основание нерастворимо в воде.2Базы можно классифицировать следующим образом:3, Al(OH)2), Al(OH)
) и амфотерные (т.е. как основные, так и кислотные (Al(OH) ).2, Zn(OH)3).
), слаборастворимый Ca(OH)2(b) слабый (a2, Fe(OH)3и растворимый NH2.
Классификация оснований
- По растворимости основания делят на растворимые — щёлочи (NaOH, KOH) и нерастворимые основания (Ca(OH)2, Al(OH)3).
- По кислотности (количеству гидроксогрупп) основания делят на однокислотные (KOH, LiOH) и многокислотные (Mg(OH23).
- По химическим свойствам их делят на оснóвные (Ca(OH)23), Zn(OH)2).
- По силе (по степени диссоциации) различают: а) сильные (α = 100 %) – все растворимые основания NaOH, LiOH, Ba(OH)22<100 %) – все нерастворимые основания Cu(OH)2Fe(OH)34OH.