Без практики теория мертва, поэтому начинайте практиковаться. Нам нужно создать электронную конфигурацию атомов углерода и серы. Сначала мы узнаем их порядковый номер, который говорит нам о количестве электронов. Углерод имеет шесть, а сера — 16.
Электронная конфигурация
Электронная конфигурация — это формула для расположения электронов в различных электронных оболочках атома химического элемента или молекулы.
В квантовой механике конфигурация электрона — это полный список волновых функций электрона, из которого с достаточной точностью (в приближении самосогласованного поля) может быть построена полная волновая функция атома.
В целом, атом как сложная система может быть описан только полной волновой функцией. Однако такое описание практически невозможно для атомов сложнее атома водорода — самого простого из всех химических элементов. Подходящим подходом является метод самосогласованных полей. В этом методе вводится понятие волновой функции каждого электрона. Волновая функция всей системы записывается как соответствующим образом симметризированное произведение волновых функций одного электрона. При вычислении волновой функции каждого электрона учитывается поле всех других электронов как внешний потенциал, который в свою очередь зависит от волновых функций других электронов.
Метод самосогласованного поля приводит к сложной системе нелинейных интегро-дифференциальных уравнений, решить которую пока сложно. Однако самосогласованные уравнения поля обладают вращательной симметрией исходной задачи (т.е. они сферически симметричны). Таким образом, можно определить волновые функции отдельных электронов, из которых получается общая волновая функция атома.
Для начала, как в любом центрально симметричном потенциале, волновую функцию в самосогласованном поле можно охарактеризовать квантовым числом полного углового момента. Волновые функции с разными значениями волновых функций. Далее, при данном значении углового момента можно перенумеровать уровни энергии. По аналогии с атомом водорода принято нумеровать уровни энергии для данного. Полный перечень квантовых чисел одноэлектронных волновых функций из которых можно составить волновую функцию атома и называется электронной конфигурацией. Поскольку всё вырожденно по квантовому числу ,
Содержание
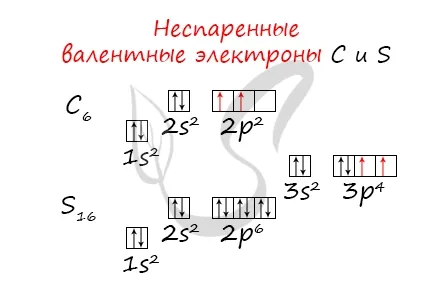
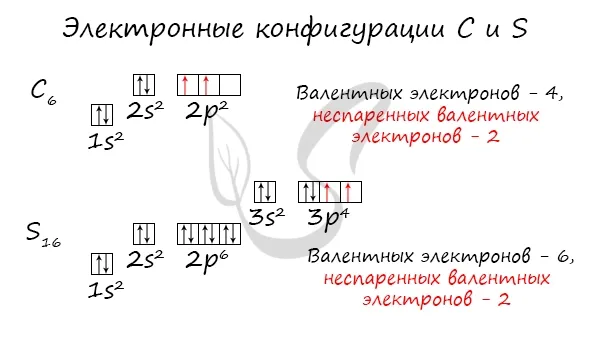
По историческим причинам в формуле электронной конфигурации квантовое число обозначается буквой — — — —, , а затем квантового числа. Поскольку такая запись несколько избыточна, иногда формулу сокращают до, т. е. опускают число
Периодический закон и строение атома
Все, кто занимается исследованием вопросов атомной структуры, начинают с инструментов, предоставляемых периодическим законом, открытым химиком Менделеевым; только поняв этот закон, физики и математики используют свой «язык» для интерпретации выявленных в нем зависимостей (этим знаменит правдивый, довольно ироничный афоризм Дж. ), но в то же время ни физики, ни математики, несмотря на совершенство, преимущества и универсальность своих инструментов, не могут проводить свои исследования отдельно от химиков, изучающих материю.
Взаимодействие представителей этих дисциплин можно наблюдать в дальнейшем развитии предмета. Открытие Э. В. Бироном (1915) вторичной периодичности внесло еще один аспект в понимание вопросов, связанных с закономерностями строения электронных оболочек. C. А. Щукарев, ученик Э. В. Бирона и М. С. Вревского, одним из первых в начале 1920-х годов высказал мысль о том, что «периодичность — неотъемлемое свойство самого ядра».
Хотя причины вторичной периодичности до конца не выяснены, существует взгляд на эту проблему, предполагающий, что одной из важнейших причин этого явления является открытая С.А. Щукаревым кайносимметрия — первое проявление новой орбитальной симметрии (греч. καινός — новый и т.д.). Кайносимметрия Шукарева — первое проявление новой орбитальной симметрии (от греч. undos — новый и от греч. symmetry — симметрия; «кайносимметрия», т.е. «новая симметрия»). К ценосимметричным элементам относятся водород и гелий, у которых наблюдается s-орбиталь, элементы от бора до неона (p-орбиталь), элементы первого переходного ряда от скандия до цинка (d-орбиталь) и лантаноиды (термин предложен С.А. Щукаревым, как и актиниды) (f-орбиталь). Как известно, кайносимметричные элементы имеют во многом иные физические и химические свойства, чем другие элементы той же подгруппы.
Ядерная физика позволила снять противоречие, связанное с «запретом» Людвига Прандтля.2 В 1920 году Щукарев сформулировал правило изотопной статистики, которое гласит, что в природе не может быть двух стабильных изотопов с одинаковым массовым числом и зарядом атомного ядра, отличающихся на единицу — один из которых неизбежно радиоактивен. Этот закон был сформулирован в окончательной форме в 1934 году австрийским физиком Й. Маттаухом и назван правилом запрета Маттауха-Щукарева.
Атомы и электроны
Мы начнем с изучения химии — мира молекул и атомов. В этой статье мы обсудим основные понятия и разберемся в электронных типах элементов.
Атом (греч. a — отрицательная частица + tomos — деление, греч. atomatos — неделимый) — это электрически нейтральная частица вещества микроскопического размера и массы, состоящая из положительно заряженного ядра (протонов) и отрицательно заряженных электронов (электронных орбиталей).
Описанная модель атома называется «планетарной моделью» и была предложена в 1913 году великими физиками Нильсом Бором и Эрнестом Резерфордом.
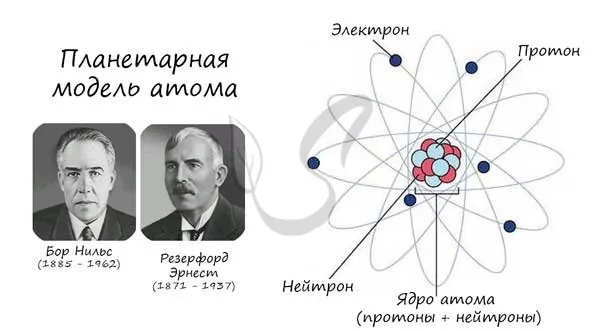
Протон (греч. proton — первый) — положительно заряженная (+1) элементарная частица, которая вместе с нейтронами образует атомные ядра элементов. Нейтрон (лат. neutral — ни тот, ни другой) — нейтральная (0) элементарная частица, встречающаяся в ядрах всех химических элементов, кроме водорода.
Электрон (греч. electron — янтарь) — стабильная элементарная частица с отрицательным электрическим зарядом (-1), заряд атома — порядковый номер в матрице Менделеева — соответствует количеству электронов (и, соответственно, протонов).
Помните, что атом в невозбужденном состоянии содержит одинаковое количество электронов и протонов. Так, кальций (число порядка 20) имеет 20 протонов в ядре и 20 электронов вокруг ядра на электронных орбиталях.

Я хотел бы объяснить этот важный
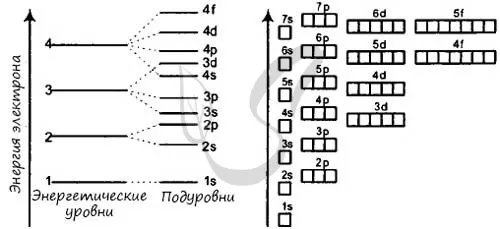
Он состоит из s-уровня: одна s-ячейка (4s 2 ), p-уровня: три p-ячейки (4p 6 ), d-уровня: пять d-ячеек (4d 10 ) и f-уровня: семь f-ячеек (4f 14 ), содержащих 14 электронов.
Зная теорию энергетических уровней и порядковый номер элемента из матрицы Менделеева, вы должны разместить определенное количество электронов, начиная с самого низкого энергетического уровня и поднимаясь к самому высокому. Далее вы увидите несколько примеров и узнаете об исключении, которое только подтверждает заданные правила.
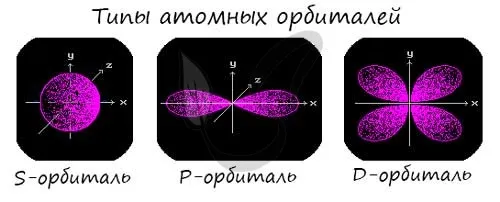
Подуровни «s», «p» и «d», о которых мы только что говорили, имеют определенную конфигурацию в пространстве. Электроны перемещаются по этим подуровням или атомным орбиталям и образуют определенный «узор».
Ядро S выглядит как сфера, ядро p — как песочные часы, а ядро d — как клеверный лист.
Правила заполнения электронных орбиталей и примеры
- Сперва следует заполнить орбитали с наименьшей энергией, и только после переходить к энергетически более высоким
- На орбитали (в одной «ячейке») не может располагаться более двух электронов
- Орбитали заполняются электронами так: сначала в каждую ячейку помещают по одному электрону, после чего орбитали дополняются еще одним электроном с противоположным направлением
- Порядок заполнения орбиталей: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s