Физика 11 класс (В.А. Касьянов, 2002), задание № 16 к главе «Постоянный электрический ток». §16 Электрический ток в растворах и расплавах электролитов.
Ответы на вопросы «Постоянный электрический ток. § 16. Электрический ток в растворах и расплавах электролитов»
Электролиты — это вещества, которые при растворении или плавлении проявляют ионную проводимость. Когда полярный диэлектрик растворяется в воде, в полученном растворе образуются свободные заряды, что позволяет раствору повышать силу тока.
Электролитическая диссоциация — это процесс, в котором молекулы электролита диссоциируются на положительные и отрицательные ионы под действием растворителя.
При динамическом равновесии степень диссоциации (отношение числа молекул, распавшихся на ионы, к общему числу молекул) остается постоянной.
Какое физическое явление называют электролизом?
Электролиз — процесс выделения веществ, образующих электролит, при прохождении электрического тока через расплав или его раствор.

— Масса вещества, выделяющегося на электроде, прямо пропорциональна заряду, прошедшему через расплав или раствор электролита.

Здесь F — постоянная Фарадея, M — молекулярная масса вещества, n — валентность и Q — заряд.
Каково применение электролиза в технике?
Гальваника, электрометаллургия, отделка металлов.

Физика 11 класс (В.А. Касьянов, 2002), задание № 16 к главе «Постоянный электрический ток». §16 Электрический ток в растворах и расплавах электролитов.
Диссоциация электролитов
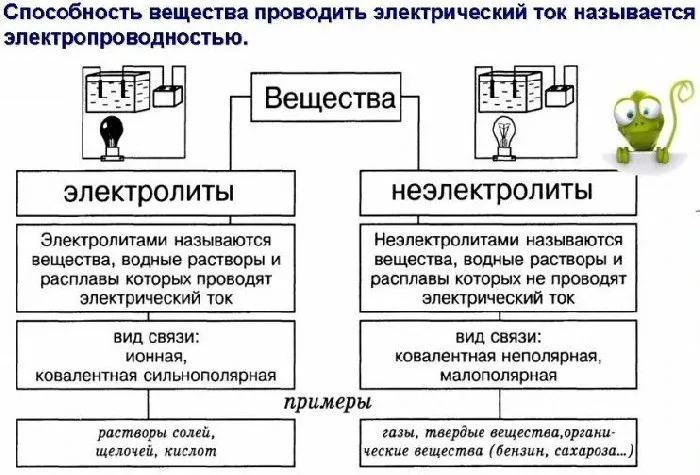
Электролиты — это вещества с ионными или сильно полярными ковалентными связями. Первые присутствуют в виде ионов до перехода в растворенное или расплавленное состояние. Электролиты включают соли, основания и кислоты.
Различают сильные и слабые электролиты. Сильные электролиты полностью растворяются в ионах при растворении в воде. К ним относятся почти все растворимые соли, многие неорганические кислоты (например, H2SO4HNO3HCl), а также гидроксиды щелочей и щелочноземельных металлов. Слабые электролиты легко распадаются на ионы при растворении в воде. К ним относятся почти все органические кислоты, некоторые неорганические кислоты (например, H2CO3), многие гидроксиды (кроме гидроксидов щелочей и щелочноземельных металлов).
Вода также является слабым электролитом.
Как и другие химические реакции, электролитическое разложение в растворах описывается в терминах уравнений разложения. В случае сильных электролитов процесс считается необратимым, в то время как в случае средних и слабых электролитов он обратим.
Кислоты — это электролиты, разложение которых в водных растворах происходит с образованием ионов водорода в виде катионов. Полибазовые кислоты делятся на ступени. Каждый последующий этап становится все более сложным, поскольку ионы, образующиеся из кислотных остатков, являются более слабыми электролитами.
Основания — это электролиты, которые диссоциируют в водном растворе и образуют гидроксид-ион OH- в качестве аниона. Образование гидроксид-иона является общей особенностью оснований и отвечает за общие свойства сильных оснований: их щелочной характер, горький вкус, горький аромат и тот факт, что они очень сильные.
Электролитическое разложение — это разложение электролитов на ионы при их растворении в воде.2Теория электролитического разложения (С. Аррениус, 1887) в ее современном понимании включает следующие утверждения:
Гидратация ионов является экзотермическим процессом. Соотношение между отданной и полученной энергией определяет потенциал ионизации в растворе. При растворении вещества с полярной ковалентной связью (например, хлористого водорода HCl) диполи воды выравниваются с соответствующими полюсами растворенной молекулы, поляризуя связь и преобразуя ее в ионную связь, после чего происходит гидратация ионов. Этот процесс обратим и может быть полным или частичным.
Теория электролитической диссоциации
Электролиты — это растворы, содержащие заряженные частицы, участвующие в переносе заряда между электродом и катодом. Они могут быть как сильными, так и слабыми. Процесс расщепления молекул на ионы называется электролитическим расщеплением. Неэлектролиты — это водные растворы, в которые вещество перешло в виде молекул, сохранив при этом свою первоначальную структуру. Все молекулы вещества в таких растворах окружены гидратационными оболочками (молекулами воды) и не могут нести электрический заряд.
Растворение кристалла соли
Имеются цилиндрические и прямоугольные проводники. Специалисты и менеджеры по продукции компании Plast помогут вам выбрать и установить цену на интересующую вас продукцию. Воздуховоды используются в промышленных и бытовых установках, они устойчивы к химическим веществам и коррозии.

- электролиты при растворении в воде распадаются (диссоциируют) на ионы – положительные (катионы) и отрицательные (анионы). Ионизация происходит легче всего для соединений с ионной связью (солей, щелочей), которые при растворении (эндотермический процесс разрушения кристаллической решетки) образуют гидратированные ионы.
Химически стойкие промышленные воздуховоды Plast-Product предназначены для гальванических заводов и производственных площадок с агрессивными парами. Они изготавливаются из химически стойких пластмасс, таких как полипропилен, ПНД, ПВХ и ПВДФ, причем материал и свойства выбираются в соответствии с требованиями заказчика.
- гидратированные ионы устойчивы, беспорядочно передвигаются в растворе. Под действием электрического тока движение приобретает направленный характер: катионы движутся к отрицательному поясу (катоду), а анионы – к положительному (аноду).
- диссоциация (ионизация) – обратимый процесс. Полнота ионизации зависит от природы электролита (соли щелочи диссоциируют практически нацело), его концентрации (с увеличением концентрации ионизация идет труднее), температуры (повышение температуры способствует диссоциации), природы растворителя (ионизация происходит только в полярном растворителе, в частности, в воде).
Электролиты: свойства и классификации
Гальванические волокнистые фильтры предназначены для высокоэффективной очистки выхлопных газов от жидких и водорастворимых твердых частиц и аэрозольных паров в гальванической, травильной и химической промышленности, из вытяжных шкафов, лабораторных помещений, из моечных камер для обработки поверхностей. Его можно использовать в пищевой промышленности.

Компания «Пласт-Продукт» производит абсорбционные скрубберы и центробежное абсорбционное оборудование, используемое для очистки воздуха от пылегазовоздушных смесей и токсичных испарений.
Воздуховоды хим стойкие
Если вас интересуют затраты на производство продукции, напишите нам технический проект по адресу info@plast-product.ru или позвоните по телефону 8 800 555-17-56.
Вентиляторы промышленные коррозионностойкие и химстойкие
Электролиты включают кислоты, основания и соли. Их молекулы содержат либо ионные, либо ковалентные сильные полярные связи. К неэлектролитам относятся, например, водород, кислород, сахар, бензол, эфир и многие другие органические вещества. Молекулы этих веществ имеют ковалентные малополярные и неполярные связи.
Фильтры волокнистые гальванические (ФВГ, ФКГ)
Теория электролитического разложения, созданная С. Аррениусом в 1887 году, позволяет объяснить электропроводность растворов и расплавов электролитов. Факт, что молекулы кислот, солей и оснований растворяются или объединяются в ионы — положительно и отрицательно заряженные. Этот процесс называется разложением или ионизацией.
Скруббер
Сами ионы хаотично перемещаются в растворе или расплаве. Более того, помимо разложения, одновременно происходит и противоположный процесс — объединение ионов с образованием молекул (объединение или моляризация). Из этого можно сделать вывод, что диссоциация обратима.
Когда электрический ток проходит через раствор или расплавленный электролит, положительно заряженные ионы движутся к отрицательно заряженному электроду (катоду), а отрицательно заряженные ионы — к положительно заряженному электроду (аноду). Поэтому ионы первого типа называются «катионами», а ионы второго типа — «анионами». Катионы могут быть ионами металлов, ионами водорода, ионами аммония и т.д. Анионы — это гидроксид-ионы, ионы кислотного остатка и другие.
Какие вещества являются электролитами и неэлектролитами
Различные электролиты в водных растворах могут быть полностью или неполностью разложены на ионы. Первые называются сильными электролитами, а вторые — слабыми электролитами. Число, показывающее, какая доля от общего числа молекул растворенного вещества растворяется в ионах, называется степенью диссоциации a.
Сильные электролиты являются сильными кислотами, все соли и водорастворимые основания являются щелочами. К сильным кислотам относятся хлор, соляная кислота, серная кислота, азотная кислота, соляная кислота, бром, йод и некоторые другие. К щелочам относятся гидроксиды щелочей и щелочных земель — лития, натрия, калия, рубидия, цезия, кальция, стронция и бария.
Степень диссоциации, сильные и слабые электролиты
- Как проверить электролит в аккумуляторе
- Какие свойства у электролитов
- Как менять электролит
- Как доливать электролит аккумуляторами
- Литий-полимерный аккумулятор: отличие от ионного
- Как определить сильные электролиты
- Что такое диссоциация солей
- Как определить ионную связь
- Как определить заряд иона
- Неорганические вещества: примеры и свойства
- Как устроены батарейки
- Как заменить электролит в аккумуляторе
- Как поменять электролит в аккумуляторе
- Как добавить электролит в аккумулятор
- Как определять ионы
- Как усилить гидролиз
- Как слить электролит
- Как ослабить или усилить гидролиз
- Как происходит гидролиз солей и какова его функция
- Какая разница между солевыми и алкалиновыми батарейками
- Что такое гидролиз солей в современной химии
- Как писать ионные уравнения
- Что такое электролиз