Электроотрицательность x — это способность атома притягивать (удерживать) внешние электроны (валентность). Электроотрицательность определяется степенью притяжения внешних электронов к ядру и зависит в основном от радиуса атома и заряда ядра.
Давайте вспомним, как образуются химические связи. Давайте представим себе атом: Он состоит из положительно заряженного ядра и нескольких отрицательно заряженных электронов, расположенных в разных плоскостях. Внешний уровень называется валентным, на нем расположены валентные электроны. Они могут либо образовывать пары, либо быть свободными, т.е. не иметь пар.
Именно свободные электроны во внешней оболочке участвуют во взаимодействии между двумя атомами. Чем больше у атома свободных электронов, тем больше химических связей может быть образовано.
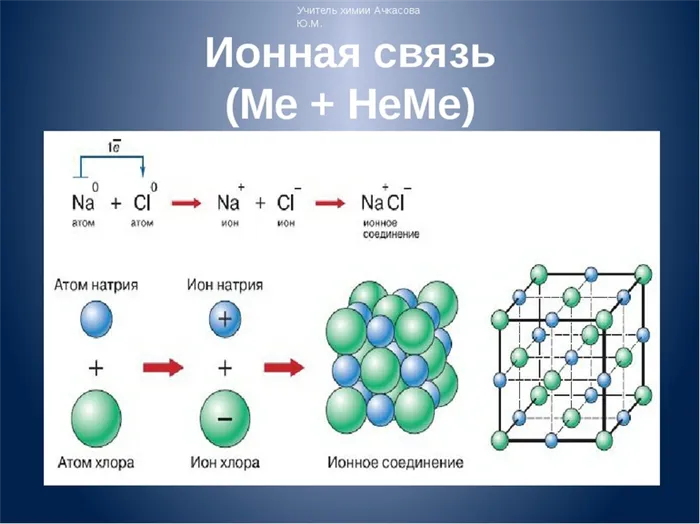
В этом случае каждый атом стремится к стабильной конфигурации — внешней оболочке с двумя или восемью электронами, как у благородного газа. Атом может достичь этого, отдавая или принимая некоторые электроны или образуя общую электронную пару с другим атомом. Когда в результате образуются два противоположно заряженных иона, это называется ионной связью. Она характерна для взаимодействия между металлическими и неметаллическими атомами.
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Зарегистрируйтесь и примите участие в розыгрыше 8 уроков.

Определение ионной связи
Рассмотрим этот тип связи на примере натрия и водорода, что приводит к образованию гидрида натрия. Атом натрия Na имеет один свободный электрон во внешней оболочке, а атому водорода H не хватает одного электрона, чтобы заполнить внешнюю оболочку и принять стабильную форму. Поскольку натрий имеет более низкую электроотрицательность, чем водород, он отдает свой валентный электрон и приобретает отрицательный заряд. Водород принимает этот электрон и получает положительный заряд. В результате образуются два иона — катион Na+ и анион H-.
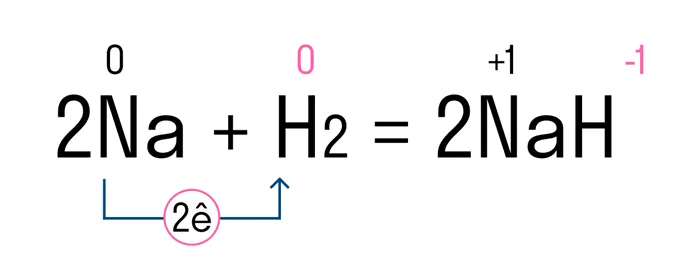
Между положительным ионом Na+ и отрицательным ионом H- возникает электростатическое притяжение, которое удерживает их вместе. Это создает ионную связь в гидриде натрия.
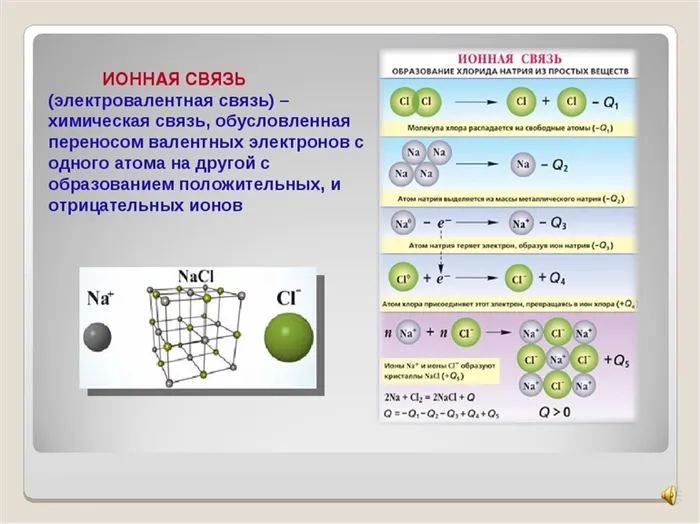
Ионная связь — это тип химической связи, характеризующийся наличием противоположно заряженных ионов, образующихся в результате присоединения и отдачи электронов атомами. Он вводится элементами с большой разницей в электроотрицательности. Таким образом, атомы металла и неметалла обычно взаимодействуют.
Это наиболее распространенный тип связи щелочных и щелочноземельных металлов и галогенов. Поскольку щелочные металлы обладают меньшей электроотрицательностью, их атомы становятся катионами, а атомы галогенов — анионами.
Механизм образования ионной связи аналогичен донорно-акцепторному механизму ковалентной связи. Первое даже считается крайним проявлением второго.
При рассмотрении ковалентных химических связей основное внимание уделяется прочности — она описывает, сколько связей образует конкретный атом с другими атомами. Однако эта концепция не применима к ионным соединениям, поскольку все ионы в кристаллической решетке взаимодействуют друг с другом. Вместо этого существует координационное число, которое отражает количество этих взаимодействий.4NO3Занимайтесь по 15 минут в день. Освоить английскую грамматику и лексику. Сделайте язык частью жизни.4Ионы — это заряженные частицы, в которые превращаются атомы, когда они отдают или принимают электроны. Они очень сильно притягиваются друг к другу, поэтому вещества с таким типом связи имеют высокие температуры кипения и плавления.4Ионная связь — это химическая связь между ионами с различным сродством, возникающая в результате их электростатического притяжения. Это можно считать пограничным случаем ковалентной связи, когда разница в электроотрицательности связанных атомов настолько велика, что происходит полное разделение зарядов.41,7.
Координационное число
Разница в значении электроотрицательности тем больше, чем дальше друг от друга находятся элементы в периодической таблице. Эта взаимосвязь характерна для металлов и неметаллов, особенно для наиболее удаленных групп, таких как I и VII.
Пример: поваренная соль, хлорид натрия NaCl:
В кристаллах существует прочная, длинная, но ненасыщенная и ненаправленная ионная связь. Ионная связь характерна только для сложных веществ, таких как соли, щелочи и оксиды некоторых металлов. В газообразном состоянии эти вещества находятся в виде ионных молекул.
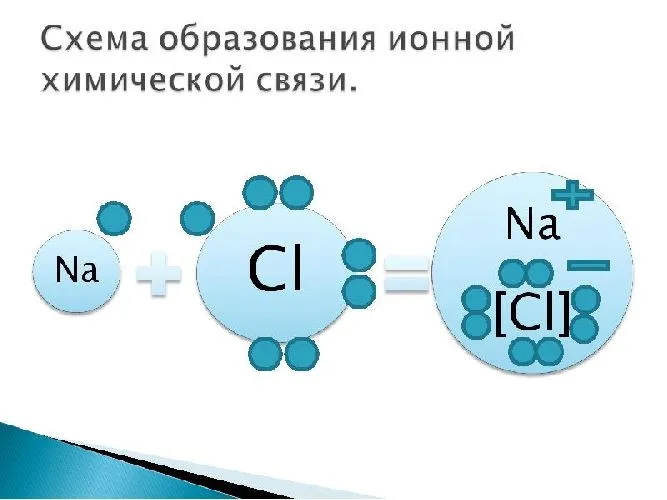
Ионные химические связи образуются между типичными металлами и неметаллами. В процессе неизбежно происходит перенос электронов от металла к неметаллу и образование ионов. Это создает электростатическое притяжение, называемое ионной связью.

Общая характеристика ионной химической связи
В действительности абсолютной ионной связи не существует. Так называемая ионная связь является частично ионной и частично ковалентной. Однако связь сложных молекулярных ионов можно считать ионной.
Существует несколько примеров образования ионных связей:
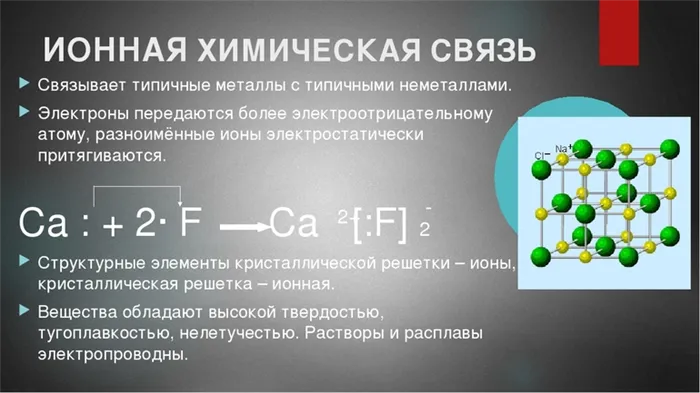
Обычно считается, что связь приобретает электронный характер, если ЭО>- Кальцию легче отдать два электрона, чем набрать недостающие электроны.
— С другой стороны, фтору легче получить один электрон, чем отдать семь электронов.
Мы должны найти наименьшее общее кратное зарядов ионов. Определим число атомов фтора, которые могут принять два электрона от атома кальция: 2 : 1 = 2. 4.
Сформулируем формулу ионной химической связи:
— Натрий относится к основной подгруппе первой группы. Он может легко отдать электрон.
— Кислород находится в главной подгруппе шестой группы. Конечно, легче получить два электрона, чем отдать шесть.
Примеры образования ионной связи
Найдем наименьшее общее кратное между La
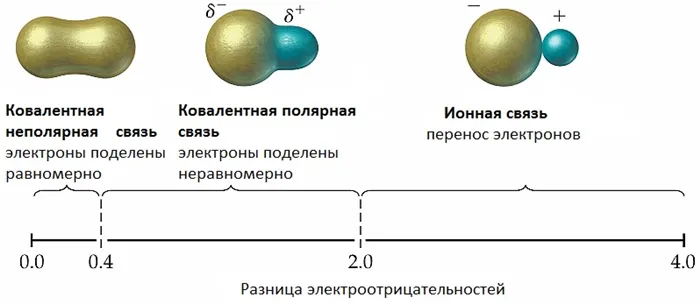
Ковалентная полярная связь — это ковалентная связь между атомами с различной электроотрицательностью (обычно различными неметаллами), характеризующаяся смещением общей электронной пары в сторону более электроотрицательного атома (поляризация).
Электронная плотность смещается к наиболее электроотрицательному атому — это приводит к появлению частичного отрицательного заряда (δ-) на этом атоме и частичного положительного заряда (δ+, дельта+) на наименее электроотрицательном атоме.
Чем больше разница в электроотрицательности атомов, тем больше полярность связи и тем больше дипольный момент. Между соседними молекулами противоположного знака действуют дополнительные притягивающие силы, увеличивающие прочность связи.
Полярность связи влияет на физические и химические свойства соединений. Механизмы реакции и даже реакционная способность соседних связей зависят от полярности связи. Полярность связи часто определяет полярность молекулы и поэтому напрямую влияет на физические свойства, такие как температуры кипения и плавления и растворимость в полярных растворителях.
- взаимодействие натрия и кислорода
Ковалентные химические связи могут образовываться по двум механизмам:
1. Механизм обмена в ковалентной химической связи заключается в том, что каждая частица предоставляет неспаренный электрон для образования общей электронной пары:
2. Донорно-акцепторный механизм ковалентной связи — это когда одна из частиц предоставляет неспаренную электронную пару, а другая частица предоставляет пустую орбиталь для этой электронной пары:
Один из атомов предоставляет неделимую электронную пару (донор), а другой атом предоставляет пустую орбиталь для этой пары (акцептор). Образование связи уменьшает энергию двух электронов, т.е. выгодно для атомов.
H. +. H = H:H
Ковалентная связь, образованная по донорно-акцепторному механизму, не отличается по своим свойствам от других ковалентных связей, образованных по обменному механизму. Образование ковалентных связей по донорно-акцепторному механизму характерно для атомов с большим количеством электронов на внешнем энергетическом уровне (доноры электронов) или, наоборот, с очень малым количеством электронов (акцепторы электронов). Более подробно валентный потенциал атомов рассматривается в соответствующей статье.
Ковалентная связь образуется по донорно-акцепторному механизму
— В молекуле угарного газа CO (связь в молекуле тройная, 2 связи образуются по механизму обмена, одна по донорно-акцепторному механизму): C≡O,
Ковалентная полярная химическая связь
— в ионе аммония NH
+, в ионах органических аминов, например, в ионе метиламмония CH
-NH
— в комплексных соединениях — химическая связь между центральным атомом и группами лигандов, например, в тетрагидроксиалюминате натрия NaAl(OH)
Механизмы образования ковалентной связи
связь между алюминием и гидроксид-ионами,
— в азотной кислоте и ее нитратах: HNO
А. +. В= А:В
NaNO
в некоторых других азотных соединениях,
— В молекуле озона O
Ковалентные связи обычно образуются между неметаллическими атомами. Самый важный
В молекуле кислорода O
кратность связи равна 2, поскольку каждый атом имеет два неспаренных электрона на внешнем энергетическом уровне: O=O.4В молекуле азота N3кратность связи равна 3, поскольку каждый атом имеет 3 неспаренных электрона на внешнем энергетическом уровне, и атомы вместе образуют 3 электронные пары N≡N.3+ ;
Длина химической связи — это расстояние между центрами ядер атомов, образующих связь. Она определяется экспериментальными физическими методами. Длина связи может быть аппроксимирована правилом сложения, согласно которому длина связи в молекуле AB приблизительно равна половине суммы длин связей в молекулах A4и Б.
Ионная связь — это химическая связь, основанная на электростатическом притяжении ионов.3Ионы образуются в результате принятия или отнятия электронов от атомов. Например, все атомы металлов слабо удерживают электроны внешнего энергетического уровня. Поэтому атомы металлов характеризуются восстановительными свойствами — способностью отдавать электроны.3Пример. Атом натрия содержит 1 электрон на энергетическом уровне 3. Атом натрия легко сдается, образуя гораздо более стабильный ион Na+, который имеет электронную конфигурацию благородного газа Ne. Ион натрия содержит 11 протонов и только 10 электронов, так что общий заряд иона составляе т-10+11 = +1:
— 1e = +11 Na + )3.
Основные характеристики ковалентной связи
Пример. Атом хлора на внешнем энергетическом уровне содержит 7 электронов. Чтобы получить конформацию стабильного инертного атома аргона Ar, хлор должен нести 1 электрон. После присоединения электрона образуется стабильный ион хлора, состоящий из электронов. Общий заряд иона раве н-1:
Кратность химической связи
+ 1e = +17 Cl — )
+, сульфат-ион SO2Образовавшиеся ионы притягиваются электрическим притяжением: Na + Cl -, Na + Cl -, Na
+ SO22- .
Давайте подытожим разницу между ковалентной и ионной связью:2Тип химической связи влияет на свойства вещества и его поведение в растворах. Чем сильнее химическая связь между частицами, тем труднее растворить их друг в друге и тем труднее превратить твердое состояние в газ или жидкость. Попытайтесь определить, какие частицы имеют больше сил взаимодействия друг с другом.
Длина ковалентной связи
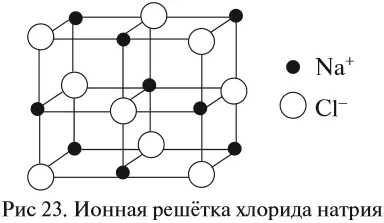
Если силы притяжения частиц велики (притяжение противоположно заряженных ионов), частицы колеблются около положения равновесия и не могут двигаться, сохраняя таким образом свою форму и объем. Максимальное взаимодействие между частицами происходит в случае I (ионная связь). Эти вещества находятся в твердом состоянии. Все вещества с ионной структурой являются твердыми. Между ионными веществами нет ни жидкостей, ни газов! Эти вещества характеризуются особой внутренней структурой — кристаллической решеткой:2По2:
Ионная химическая связь
Эти вещества твердые, тугоплавкие, а их расплавы проводят электричество. Ионные соединения обычно хорошо растворимы в жидкостях, состоящих из полярных молекул, таких как вода, хотя бывают и исключения.
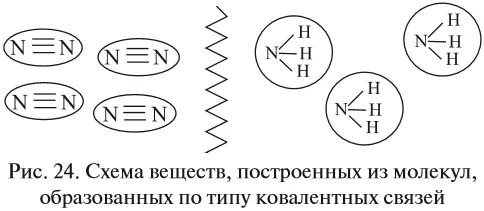
Большинство веществ, образованных ковалентными связями, состоят из отдельных молекул (Рисунок 24).
К таким веществам относятся спирты, сахара и большинство органических соединений. Когда такое вещество становится твердым, эти молекулы образуют молекулярную кристаллическую решетку, т.е. в ее узлах находятся молекулы.
+11 Na )2)8)1Кристаллические решетки, состоящие из (полярных и неполярных) молекул, называются молекулярными решетками. Молекулы в этих решетках связаны относительно слабыми межмолекулярными силами. Поэтому молекулярные решетки обладают низкой прочностью и низкой температурой плавления, а их растворы трудно проводить. Существует лишь несколько неорганических веществ с молекулярной решеткой: вода, кислоты.2)8
Кристаллические решетки, в узлах которых находятся отдельные атомы, называются атомными решетками. Атомы в таких решетках соединены прочными ковалентными связями. Алмаз, одна из модификаций углерода, является хорошим примером. Алмаз состоит из атомов углерода, каждый из которых соединен с четырьмя соседними атомами:
+17 Cl )2)8)7Весь кристалл алмаза следует рассматривать как одну гигантскую молекулу. Атомная кристаллическая решетка характерна для твердых бора, кремния, германия и соединений некоторых элементов с углеродом и кремнием, а также для кварца — чистого оксида кремния. Эти вещества очень твердые и тугоплавкие. Они нерастворимы в воде и других растворителях.2)8)8
Обратите внимание:
- Свойства ионов отличаются от свойств атомов!
- Устойчивые ионы могут образовывать не только атомы, но и группы атомов. Например: ион аммония NH4В отличие от металлической связи, где связь образуется парой металлических элементов, при образовании ионной связи в качестве связующего агента выступают атомы металлического и неметаллического элементов. Типичные металлы охотно делятся электронами, а типичные неметаллы с такой же готовностью принимают их. Донорный атом называется атомом-донором, а акцепторный атом — атомом-акцептором.42- и др. Химические связи, образованные такими ионами, также считаются ионными;
- Ионную связь, как правило, образуют между собой металлы и неметаллы (группы неметаллов);
Когда образуется соединение, неметаллический атом принимает электроны на своем внешнем энергетическом уровне, завершая соединение. В результате он приобретает стабильную конфигурацию с восемью электронами (согласно правилу восьми). Это означает, что механизм ионной связи в основном следующий: Противоположно заряженные ионы образуют устойчивую связь после притяжения друг к другу.2Атомы с почти полной или почти пустой внешней оболочкой (валентной) участвуют в химических реакциях максимально легко. Полнота этого слоя играет решающую роль в обмене электронами. Небольшое количество пустых орбиталей во внешней оболочке дает атому больше шансов принять электроны извне. Напротив, ничтожно малое число электронов в валентной оболочке увеличивает вероятность того, что атом пожертвует электроном.4Электроотрицательность атома химического элемента выражается его способностью притягивать электроны в свою внешнюю оболочку. Чем полнее валентная оболочка атома, тем выше его электроотрицательность. Значения электроотрицательности связаны с положением элементов в периодической таблице Менделеева — чем дальше они находятся друг от друга (расстояние в основном оценивается по группе), тем больше разница между значениями. По этой причине ионные соединения особенно характерны для металлов и неметаллов, которые находятся дальше друг от друга в системе (например, в группах I и VII).
Помимо простой ионной связи, особенно примечательна молекулярная форма связи. Главной особенностью этого типа связи является то, что ионы представляют собой целые молекулы, а не отдельные атомы, как в обычной связи.
Химическая связь и агрегатные состояния вещества. Кристаллические решётки
Рассматривая подробно, как взаимодействие атомов с противоположными зарядами приводит к образованию ионных связей, стоит рассмотреть несколько простых примеров.

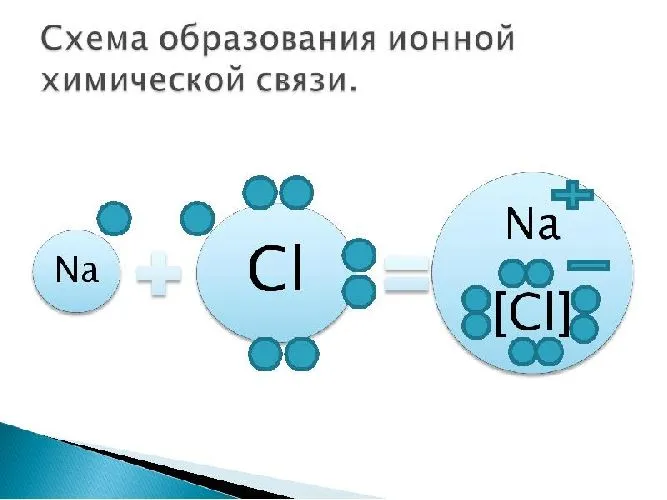
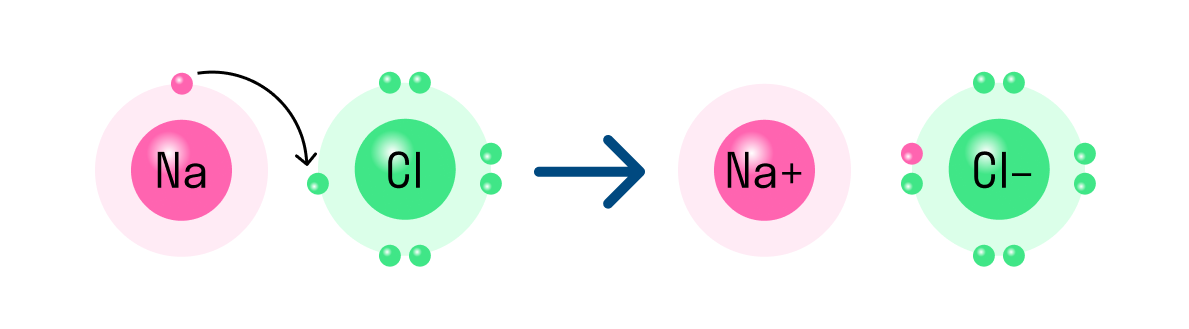
Первый пример — это общее описание механизма формирования. Для образования такого соединения, как хлорид натрия или, проще говоря, поваренная соль, достаточно всего лишь химической реакции. Это атомы щелочного металла (натрий Na) и галогена (хлор Cl), который имеет один электрон во внешнем энергетическом слое, в то время как галоген имеет семь электронов, то есть ему нужен только один электрон для заполнения внешнего слоя.
Единственный валентный электрон атома металла имеет слабую связь с ядром, поэтому Na легко отдает эту частицу. В результате во внешнем энергетическом слое образуется свободное пространство. Таким образом, оба участника склеивания полностью заполняют свои внешние оболочки. Отдав электрон, атом металла превращается в катион натрия Na+, а атом неметалла, принявший электрон, превращается в хлорид-ион Cl-. Образовавшиеся ионы притягиваются друг к другу — образуется ионная связь.
Схема процесса превращения атомов натрия и хлора в ионы соответствующих элементов и образования из них ионных соединений выглядит следующим образом (в скобках отмечены электронные слои структуры атомов): Na 0 )2e)8e)1e + Cl 0 )2e)8e)7e = Na+)2e)8e + Cl-)2e)8e)8e = Na+)2e)8e)Cl-)2e)8e. Аналогичная процедура в виде формулы выглядит следующим образом: Na 0 + Cl 0 = Na+ + Cl- = Na+Cl-
Таким образом, формула вещества с ионной связью (поваренная соль в приведенном выше примере) имеет следующий вид: Na+Cl- (т.е. один участник взаимодействия получает положительный заряд, а другой, напротив, отрицательный). Ионные вещества всегда имеют сложный состав — они не состоят из одного элемента. Это соединение характерно для следующих веществ:
Они имеют кристаллические решетки ионного типа.
Что касается элементов, то натрий является одним из наиболее подходящих элементов периодической таблицы Менделеева для примера ионной связи. Это связано с низкой электроотрицательностью и наличием одного электрона во внешней оболочке. Вторым примером образования ионной связи также является натрий. Вещество, о котором идет речь, — фторид натрия. Участниками этого процесса являются натрий Na и фтор F.
По наиболее важным для исследуемого процесса свойствам фтор похож на хлор — у него высокая электроотрицательность и семь электронов во внешнем слое. Поэтому он также очень подходит для изучения ионной эталонной связи.
Фторид натрия образуется в результате
Эти соединения очень устойчивы — настолько устойчивы, что их очень трудно разрушить тепловой энергией. Однако из-за относительно небольшого радиуса ионного взаимодействия эти соединения обладают завидным свойством хрупкости. Сама энергия связи прямо пропорциональна кратности связи, т.е. количеству общих электронных пар.
Процесс взаимодействия
Ионные соединения хорошо растворимы в полярных растворителях, таких как вода, кислоты и другие растворители. Эта особенность обусловлена заряженностью молекулярных частей. Помимо растворимости, ионные соединения также обладают следующими характеристиками:
Последние два характерных свойства ионной связи отличают их от других типов химических соединений. Благодаря этим свойствам кристаллы ионных соединений притягиваются к различным более плотным упаковкам соответствующих ионов.

Примеры возникновения
- солей;
- щелочей;
- оксидов некоторых металлов.
Особенности связи

- прочность;
- длина;
- поляризуемость;
- полярность;
- ненасыщаемость;
- ненаправленность.