Относительная атомная масса элемента (Ar) показывает, во сколько раз масса его атома больше 1/12 массы атома углерода. Эта величина постоянна для каждого элемента и может быть прочитана в таблице Менделеева.
Пример 1. Определите массовые доли химических элементов в серной кислоте H 2 SO 4 и укажите их в процентах.
Рассчитайте относительную молекулярную массу серной кислоты:
Mr (H 2 SO 4) = 1 — 2 + 32 + 32 + 16 — 4 = 98
Вычислите массовые доли элементов.
Для этого разделите численное значение массы элемента (с индексом) на молярную массу вещества:
Учитывая это и обозначая массовую долю элемента буквой ω, расчет массовых долей производится следующим образом:
ω(H) = 2: 98 = 0,0204, т.е. 2,04 %,
ω(S) = 32: 98 = 0,3265, т.е. 32,65 %,
ω(O) = 64: 98 = 0,6531, т.е. 65,31 %.
Пример 2. Определите массовые доли химических элементов в глиноземе Al 2 O 3 и укажите их в процентах.
Решение
1. Рассчитайте относительную молекулярную массу глинозема:
Mr(Al 2 O 3) = 27 — 2 + 16 — 3 = 102
2. рассчитать массовые доли элементов:
ω(Al) = 54: 102 = 0,53 = 53 %.
ω(O) = 48: 102 = 0,47 = 47 %.
Как вычислить массовую долю вещества в кристаллогидрате
Массовая доля вещества — это отношение массы конкретного вещества в системе к массе всей системы, т.е. ω(X) = m(X) / m,
где ω(X) — массовая доля вещества X,
m(X) — масса вещества X,
m — масса всей системы
Массовая доля является безразмерной величиной. Она выражается в долях единицы или в процентах.
Пример 1. Определите массовую долю кристаллизационной воды в дигидрате хлорида бария BaCl 2-2H 2 O.
Решение
Молярная масса BaCl 2-2H 2 O составляет:
M(BaCl 2-2H 2 O) = 137+ 2 — 35,5 + 2 — 18 = 244 г/моль.
Из формулы BaCl 2-2H 2 O следует, что 1 моль дигидрата хлорида бария содержит 2 моль H 2 O. Из этой формулы можно определить массу воды, содержащейся в BaCl 2-2H 2 O:
m(H2O) = 2 — 18 = 36 г.
Определите массовую долю кристаллизационной воды в дигидрате хлорида бария BaCl 2-2H 2 O.
ω(H 2 O) = m(H 2 O)/m(BaCl 2 — 2H 2 O) = 36 / 244 = 0,1475 = 14,75 %.
Пример 2. Из образца породы массой 25 г, содержащего аргентит Ag 2 S, извлечено 5,4 г серебра. Определите массовую долю серебра. Определите массовую долю аргентита в образце.
Определите количество серебра в аргентите:
n(Ag) = m(Ag) / M(Ag) = 5,4 / 108 = 0,05 моль.
Из формулы Ag 2 S следует, что количество аргентита меньше половины количества вещества серебра.
Определим количество вещества аргентита:
n(Ag 2 S) = 0,5 — n(Ag) = 0,5 — 0,05 = 0,025 моль.
Вычислим массу аргентита
m(Ag 2 S) = n(Ag 2 S) — M(Ag 2 S) = 0,025 — 248 = 6,2 г.
Теперь определите массовую долю аргентита в образце породы массой 25 г.
ω(Ag 2 S) = m(Ag 2 S) / m = 6,2/25 = 0,248 = 24,8 %.
Как найти массовую долю вещества по формуле
Массовая доля является одним из наиболее важных параметров, который не
Например, чтобы определить w-кислород (оксигон) в молекуле углекислого газа CO2, сначала необходимо определить молекулярный вес всего соединения. Это 44. Молекула содержит 2 атома кислорода. Поэтому w кислорода рассчитывается следующим образом:
- для компонента смеси, раствора;
- для составной части соединения (химического элемента);
- для примесей к чистым веществам.
w(O) = (Ar(O) — 2 ) / Mr(CO2)) x 100%,
w(O) = ((16 — 2) / 44) x 100% = 72,73%.
В химии, например, содержание воды в кристаллогидрате, комплексном соединении с водой, определяется аналогичным образом. В таком виде в природе встречаются многие минеральные вещества.
Формула сульфата меди, например, такова: CuSO4 — 5H2O. Чтобы определить w-значение воды в этом кристаллогидрате, нужно подставить Mr воды (в числителе) и общее m кристаллогидрата (в знаменателе) в уже известную формулу. Mr воды составляет 18, а общее количество кристаллогидрата — 250.
Нахождение массовой доли химического элемента
w( H2O ) = ((18 — 5) / 250 ) — 100% = 36%.
Массовая доля химического соединения в смеси или растворе определяется по той же формуле, но в числителе стоит масса вещества в растворе (смеси), а в знаменателе — масса всего раствора (смеси):
? = (m (вещества — m (раствора)) / 100%.
Обратите внимание, что массовая концентрация — это отношение массы вещества к массе всего раствора, а не только растворителя.
Например, растворите 10 г поваренной соли в 200 г воды. Нам нужно определить процентную концентрацию соли в полученном растворе.
Чтобы определить концентрацию соли, нам понадобится m раствора. Это:
m (раствор) = m (соль) + m (вода) = 10 + 200 = 210 (г).

Нахождение массовой доли вещества в смесях и растворах
Определите массовую долю соли в растворе:
? = ( 10 — 210) / 100% = 4,76%
Таким образом, концентрация поваренной соли в растворе составляет 4,76%.
Если в задании указан не m, а объем раствора, его необходимо перевести в массу. Обычно это делается с помощью формулы для определения плотности:
Где m — масса вещества (раствора, смеси), а V — его объем.
Это наиболее часто используемая концентрация. Именно это имеется в виду (если не указано иное), когда пишут о процентном содержании веществ в растворах и смесях.
В этой статье мы обратимся к некоторым ключевым понятиям в химии, без которых совершенно невозможно решать задачи. Попытайтесь понять концепцию физических величин, чтобы понять эту тему.
Я постараюсь привести как можно больше примеров в этой статье, и вы увидите много примеров на эту тему по мере продвижения.
Относительная атомная масса — A
Представляет собой массу атома, выраженную в единицах атомной массы. Относительные атомные веса приведены в периодической таблице Д.И. Менделеева. Так, атом водорода имеет атомную массу 1, кислорода — 16, а кальция — 40.
Относительная молекулярная масса равна M
Относительный молекулярный вес — это сумма относительных атомных весов всех атомов, входящих в состав вещества. Например, мы хотим найти относительные молекулярные веса кислорода, воды, перманганата калия и медного купороса:

Решение задач по химии
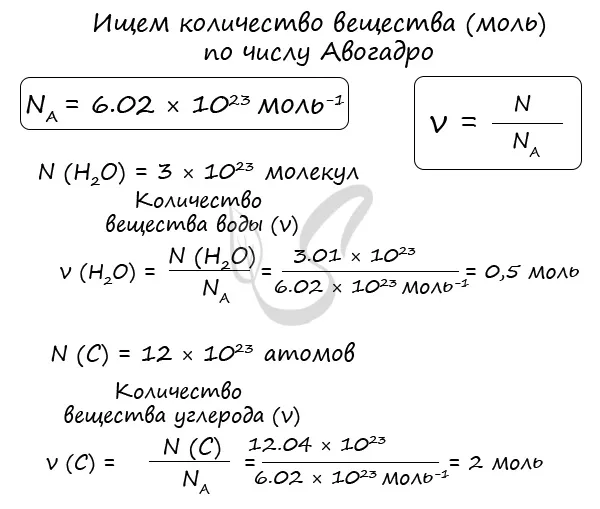
Моли и число Авогадро
Моль — единица количества вещества (в системе единиц СИ), определяемая как количество вещества, содержащее столько структурных единиц этого вещества (молекул, атомов, ионов), сколько содержится в 12 граммах изотопа 12 C.

Прежде всего, я хочу, чтобы вы поняли физический смысл изученных вами понятий. Молекула — это международная единица измерения количества вещества, показывающая, сколько атомов, молекул или ионов содержится в данной массе или объеме вещества. Одна молекула любого вещества содержит 6,02 × 10 23 атомов/молекул/ионов — это самое важное, что нужно понять сейчас.r
Иногда в заданиях дается число Авогадро, и вас просят определить количество полученного вещества (моль). В химии количество вещества обозначается N, n (по-гречески «ню»).
Рассчитаем по формуле: n = N/Nr
Количество вещества составляет 3,01 × 10 23 молекул воды и 12,04 × 10 23 атомов углерода.
Мы определили количества веществ (моль) воды и углерода. Это может показаться очень абстрактным, но без знания того, как определить количество вещества с помощью числа Авогадро, иногда невозможно решить химическую задачу.
Молекулярная масса — M
Молекулярная масса — это масса молекулы вещества, выраженная в «г/моль» (грамм/моль). Численно он соответствует относительному молекулярному весу, который мы уже изучали.AДавайте рассчитаем молекулярные массы CaCO

HCl и N
M (HCl) = A
(H) + AA(Cl) = 1 + 35,5 = 36,5 г/моль
(Н) × 2 = 14 × 2 = 28 г/моль
Полученные знания не должны быть фрагментарными, из них нужно сделать целую систему. Примечание: Мы только что вычислили молекулярные массы — массы молекул вещества. Вспомните число Авогадро.
Оказывается, несмотря на то, что в моле содержится одинаковое количество молекул (1 моль любого вещества содержит 6,02 × 10 23 молекул), молекулярные массы у них разные. Таким образом, 6,02 × 10-23 молекул N
молекул весит 28 г, а такое же количество молекул HCl весит 36,5 г.3Это происходит потому, что хотя число молекул одинаково — 6,02 × 10 23 — в их состав входят разные атомы, поэтому их массы различны.2
Вспомните, что такое концентрация раствора. Она показывает, насколько растворитель и растворитель пропорциональны друг другу, т.е. сколько растворителя содержится в единице объема или массы. Концентрация может быть безразмерной величиной, выраженной в процентах, но она также может быть выражена в виде массы или мольной доли.rОпределение массовой доли вещества является одним из способов выражения концентрации раствора.rТа же формула применима и к решениям:
M (N2) = ArЕсли требуется процентное значение, результат необходимо умножить на 100%.
Приготовьте 0,5 л раствора карбоната натрия с плотностью 1,13 г/мл. Определите массу карбоната натрия, предполагая, что концентрация раствора составляет 13%.
Решение:2Сначала нужно определить массу раствора, что легко сделать, если известны его объем и плотность. Мы используем формулу m(r-ra) = p × V
m(br) = 500 × 1,13 = 565 г.
Как вычислить массовую долю вещества в растворе
Теперь вспомните, как найти массовую долю растворенного вещества:
Поскольку концентрация раствора — это массовая доля растворенного вещества, подставим ее в уравнение:
m(E) = 0,13 × 565 = 73,45 г.
Ответ: Для приготовления раствора требуется 73,45 г карбоната натрия.