Если частицы твердого тела расположены в пространстве, т.е. образуют повторяющуюся трехмерную геометрическую структуру, то такое вещество называется кристаллом, а сама структура — кристаллической решеткой. Большинство известных нам веществ являются кристаллами. Сами частицы расположены в узлах кристаллической решетки.
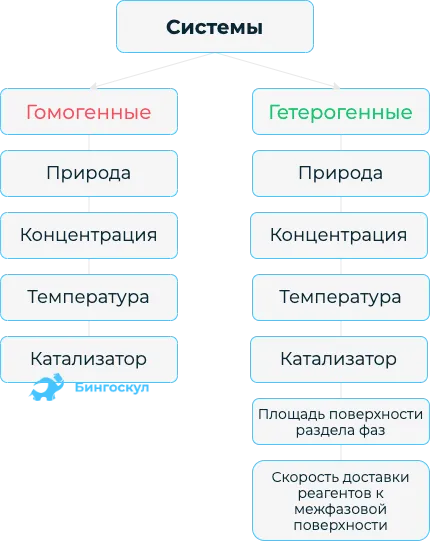
Атомная, молекулярная, ионная и металлическая кристаллическая решётка
Согласно атомной теории Бойля, все вещества состоят из молекул, которые находятся в постоянном движении. Но существует ли особая структура веществ? Или они просто состоят из молекул, которые хаотично движутся?
- Виды кристаллических решёток
- Атомная кристаллическая решётка
- Ионная кристаллическая решётка
- Молекулярная кристаллическая решётка
- Металлическая кристаллическая решётка
- Видео
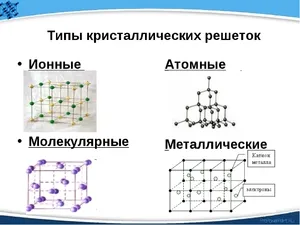
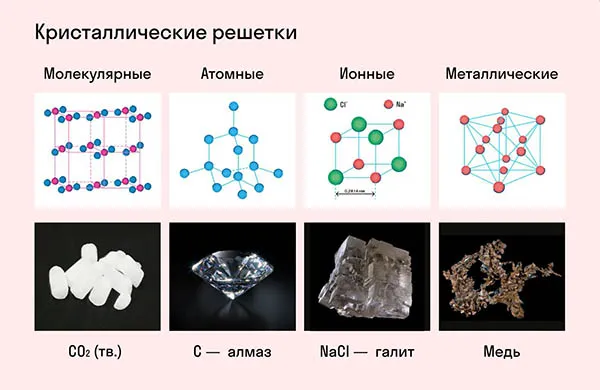
Виды кристаллических решёток
На самом деле все вещества в твердом состоянии имеют определенную структуру. Атомы и молекулы находятся в движении, но притягивающие и отталкивающие силы между частицами уравновешены, поэтому атомы и молекулы находятся в определенной точке пространства (но они продолжают слегка колебаться в зависимости от температуры). Такие структуры называются кристаллическими решетками. Точки, в которых расположены сами молекулы, ионы или атомы, называются узлами. Расстояния между узлами называются периодами идентичности. Существуют различные типы в зависимости от положения частиц в пространстве:
- атомная;
- ионная;
- молекулярная;
- металлическая.
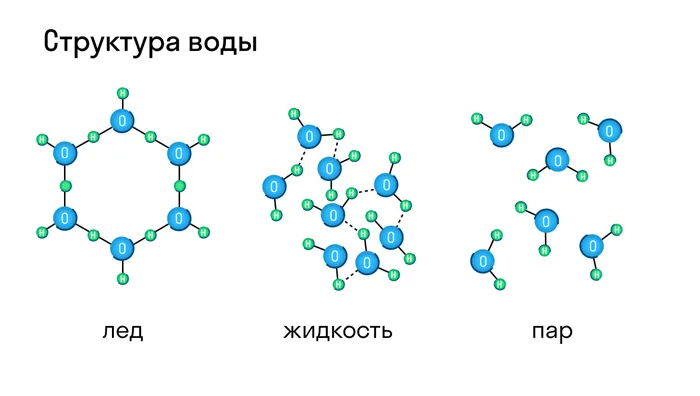
В жидком и газообразном состоянии вещества не имеют четкой решетки, их молекулы движутся хаотично, поэтому они не имеют формы. Например, кислород в газообразном состоянии представляет собой бесцветный газ без запаха, а в жидком состоянии (при температур е-194 градуса Цельсия) — голубоватый раствор. Когда температура опускается д о-219 градусов, кислород становится твердым и решетчатым, превращаясь в снежно-голубую массу.
Интересно, что аморфные вещества не имеют четкой структуры, поэтому у них нет фиксированной температуры плавления и кипения. Смола и пластилин размягчаются постепенно и становятся жидкими при нагревании, у них нет четкой переходной фазы.
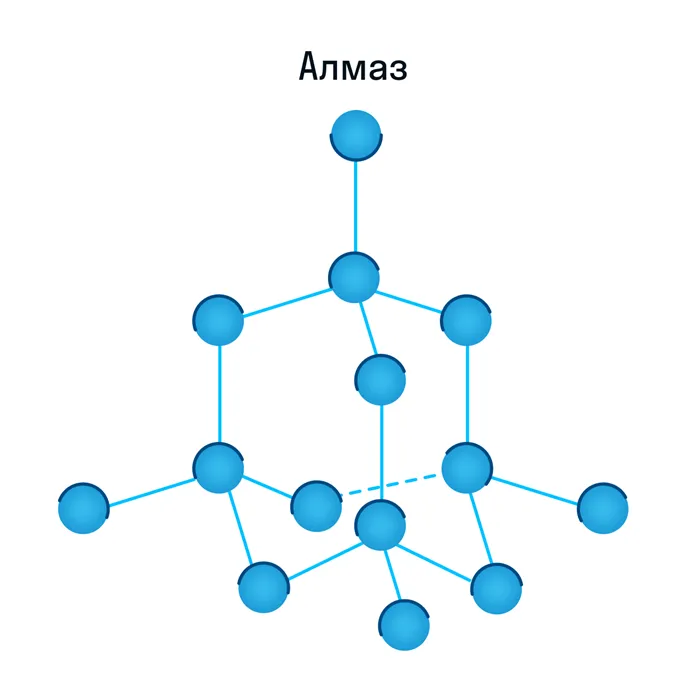
Атомная кристаллическая решётка
Узлы, как следует из названия, содержат атомы. Эти вещества очень твердые и прочные, потому что между частицами образуется ковалентная связь. Атомы в связи образуют общую пару электронов (точнее, их электронные облака перекрываются) и поэтому очень хорошо связаны друг с другом. Самый очевидный пример — алмаз, который обладает самой высокой твердостью по шкале Мооса. Интересно, что алмаз, как и графит, состоит из углерода. Графит — очень хрупкое вещество (твердость по Моосу — 1), что является хорошим примером того, насколько важен тип.
Атомные корки редко распространены в природе и включают кварц, бор, песок, кремний, оксид кремния (IV), германий и минеральные кристаллы. Эти соединения характеризуются высокой температурой плавления и высокой прочностью, а также являются очень твердыми и нерастворимыми в воде. Из-за очень прочных связей между атомами эти химические соединения практически не взаимодействуют с другими соединениями, и их очень трудно проводить.

Кристаллические решетки
Кристаллическая решетка представляет собой грубую
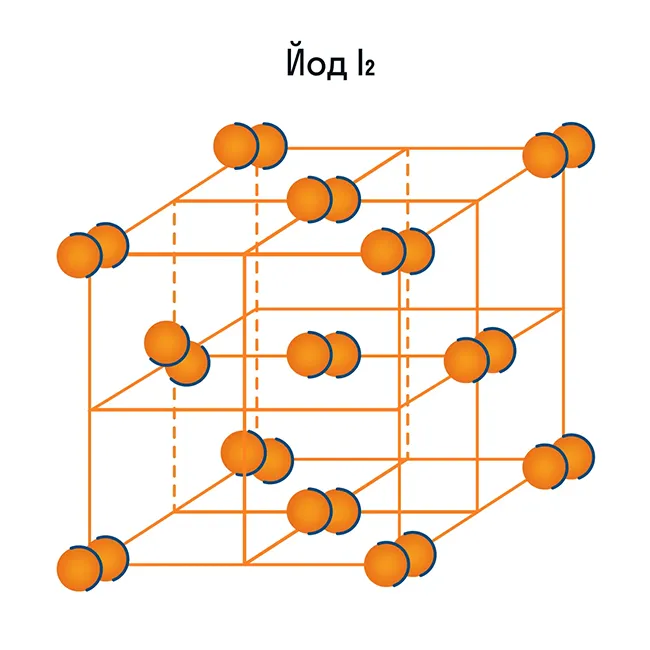
Узлы молекулярной решетки содержат молекулы. В нормальных условиях большинство газов и жидкостей имеют молекулярную решетку. Связи обычно бывают ковалентными, полярными или неполярными.
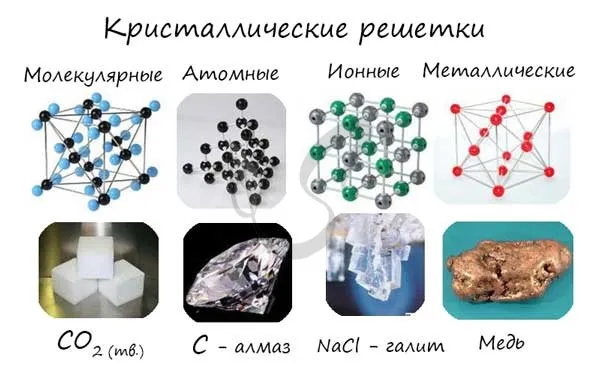
Классическим примером вещества с молекулярной решеткой является вода, поэтому ассоциируйте свойства этих веществ с водой. Вещества с молекулярной решеткой хрупкие, имеют низкую твердость, летучие, легко плавятся, могут быть восстановлены и характеризуются низкой температурой кипения.
Примеры: NH
O, Cl
, CO
Br3, H2. Особого внимания заслуживают белый фосфор, ромбическая, пластическая и моноклинная сера и фуллерен. Мы подробно рассмотрели эти аллотропные модификации в статье о классификации веществ.2Решетка ионного кристалла2, N2Узлы ионной решетки содержат атомы, соединенные ионными связями. Такой тип решетки характерен для веществ с ионной связью: Соли, оксиды и гидроксиды металлов.2, H2, I2Ассоциируйте этот ряд веществ с поваренной солью — NaCl. Вещества с ионной решеткой имеют высокие температуры плавления и кипения, легко растворяются в воде, хрупкие и твердые, а их растворы и расплавы проводят электричество.
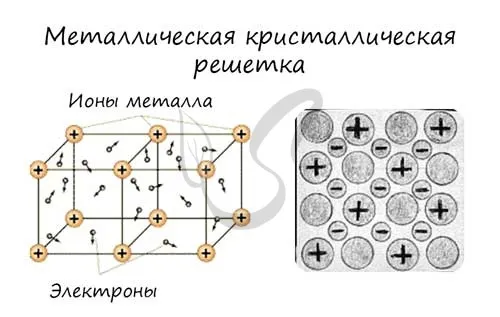
Металлическая кристаллическая решетка
Узлы металлической решетки содержат атомы металла. Такой тип решетки характерен для веществ, образованных при соединении металлов.
Соотнесите свойства этих веществ с медью. Они имеют характерный металлический блеск, ковкие и пластичные, проводящие и термостойкие, с высокими температурами плавления и кипения.
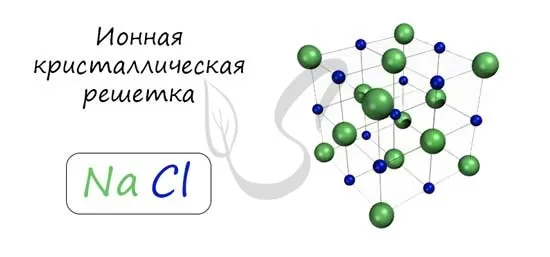
Примерами являются Cu, Fe, Zn, Al, Cr, Mn.
Узлы атомной решетки содержат атомы, которые соединены ковалентными полярными или неполярными связями.
Соедините эти вещества с песком. Они очень твердые, очень тугоплавкие (высокая температура плавления), нелетучие, твердые и нерастворимые в воде.
Примеры: SiO
B, Ge, SiC, SiC, Al
Хотелось бы отметить алмаз и графит (С), красный и черный фосфор (Р).
© Беллевич Юрий Сергеевич 2018-2022 гг.
Эта статья была написана Юрием Сергеевичем Беллевичем и является интеллектуальной собственностью Юрия Сергеевича Беллевича. Воспроизведение, распространение (включая копирование на другие сайты и интернет-ресурсы) или иное использование информации и объектов без предварительного разрешения правообладателя преследуется по закону. Для получения разрешения на использование данного материала и лицензии на его использование, пожалуйста, обращайтесь.2Юрий Беллевич.2O3Как следует из названия, кристаллическая решетка — это структура, в которой атомы расположены в виде узлов. Они взаимодействуют друг с другом посредством ковалентных связей, т.е. один атом отдает свободный электрон другому, или электроны из разных атомов образуют общую пару. В кристаллах с атомной решеткой частицы плотно прилегают друг к другу, в результате чего образуется

Атомы внутри молекул имеют сильные ковалентные связи, но сами молекулы имеют слабые связи. Поэтому кристаллы этих веществ хрупкие и легко распадаются.
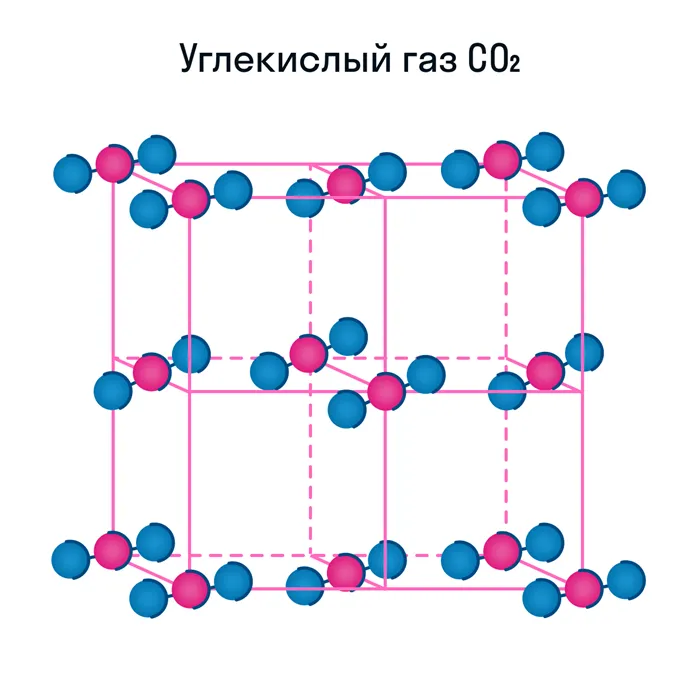
Молекулярная кристаллическая решетка характерна для воды. При комнатной температуре он жидкий, но при нагревании до (относительно низкой) температуры кипения он сразу же начинает испаряться, т.е. переходит в газообразное состояние.Некоторые молекулярные вещества — например, сухой лед CO.
B, Ge, SiC, SiC, Al
способны переходить из твердого состояния в газообразное без перехода в жидкое состояние (этот процесс называется сублимацией).
Свойства молекулярных веществ:
- прочность,
- твердость,
- неспособность к растворению в воде,
- высокая температура кипения и плавления.
Помимо воды, к веществам с молекулярной кристаллической решеткой относится аммиак N H
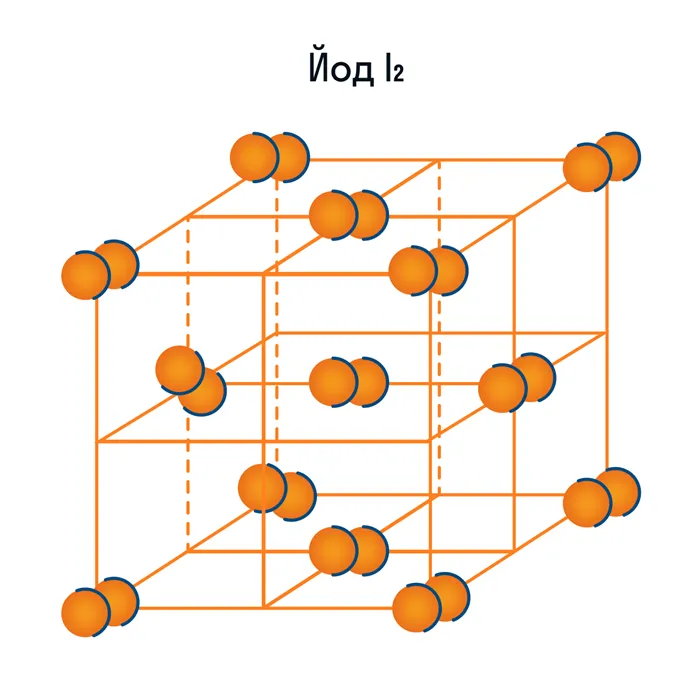
гелий He, радон Rn, йод I, азот N
и другие. Все благородные газы являются молекулярными веществами. Большинство органических соединений (например, сахар) также относятся к этой группе.
Примеры: NH
Занимайтесь 15 минут в день. Освоить английскую грамматику и лексику. Сделайте язык частью своей жизни.
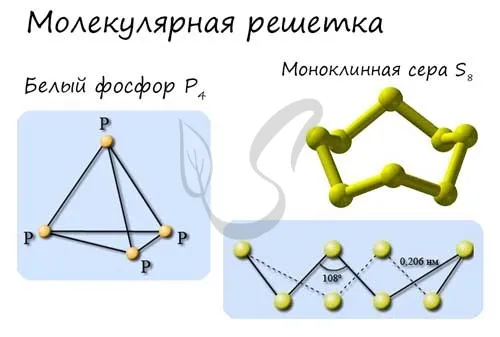
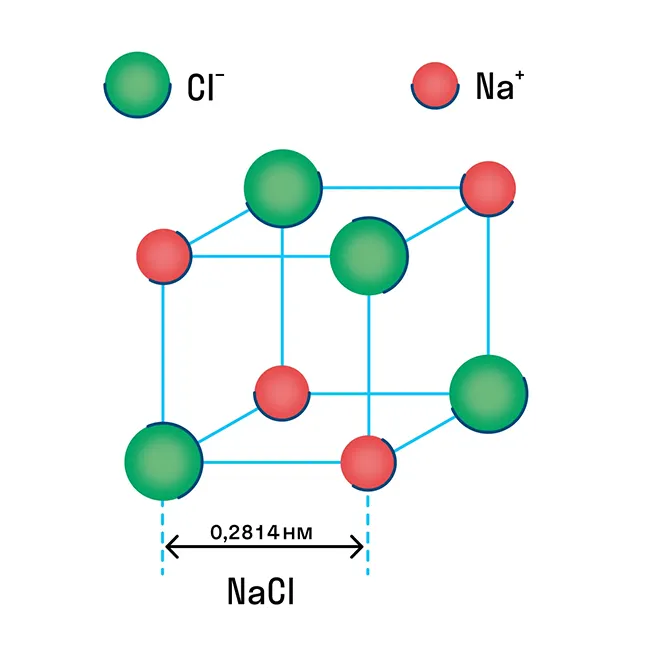
Как вы знаете, в химической ионной связи один атом отдает ионы другому атому и становится положительно заряженным, а принимающий атом становится отрицательно заряженным. В результате образуются ионы с противоположными зарядами, формирующие структуру кристалла.
Ионная решетка — это кристаллическая структура, в узлах которой ионы связаны взаимным притяжением.
Почти все соли имеют ионную решетку, и поваренная соль NaCl является типичным примером. Стоит помнить об этом, если вы хотите перечислить физические характеристики этой группы. Щелочи и оксиды активных металлов также имеют ионную решетку.
Свойства веществ с ионной структурой:2Примерами веществ с ионной кристаллической решеткой являются оксид кальция CaO, оксид магния MgO, хлорид аммония NH

Cl, хлорид магния Mg Cl
- небольшая твердость;
- низкая прочность;
- легкоплавкость;
- летучесть;
- у некоторых — наличие запаха.
оксид лития Li3O и другие.2В зависимости от частиц в кристаллической решетке существует четырнадцать типов, из которых мы представим наиболее распространенные:
Все типы кристаллических решеток более подробно описаны ниже.

Металлическая кристаллическая решетка
Как и предыдущая группа, эта группа включает вещества с ковалентными связями между атомами. Однако физические свойства этих веществ совершенно разные: они легко плавятся, становятся жидкими и растворяются в воде. Почему так происходит? Потому что кристаллы состоят не из атомов, а из молекул.
Молекулярная кристаллическая решетка — это структура, в узлах которой вместо атомов находятся молекулы.
Внутри молекул атомы имеют прочные ковалентные связи, но сами молекулы связаны лишь слабо. Поэтому кристаллы этих веществ хрупкие и легко распадаются.
Молекулярная кристаллическая решетка характерна для воды. При комнатной температуре он жидкий, но как только его нагревают до (относительно низкой) температуры кипения, он сразу же начинает испаряться, т.е. переходит в газообразное состояние.
- твердость;
- хрупкость;
- тугоплавкость;
- нелетучесть;
- электропроводность;
- способность растворяться в воде.
Некоторые молекулярные вещества, такие как CO2 в сухом льду, могут сразу переходить из твердого состояния в газообразное, минуя жидкое состояние (этот процесс называется парообразованием).4Известно, что в химической ионной связи один атом отдает ион другому и заряжен положительно, а принимающий атом заряжен отрицательно. В результате образуются противоположно заряженные ионы, которые формируют кристаллическую структуру.2Ионная решетка — это кристаллическая структура, в узлах которой ионы связаны взаимным притяжением.2Почти все соли имеют ионную кристаллическую решетку — наиболее распространенным примером является обычная поваренная соль NaCl. Вы должны иметь это в виду, когда вам нужно будет перечислить физические характеристики этой группы. Щелочи и оксиды активных металлов также имеют ионную сеть.
Виды решеток
Свойства веществ с ионной структурой:
- Ионная кристаллическая решетка.
- Атомная кристаллическая решетка.
- Молекулярно-кристаллическая решетка.
- Металлическая кристаллическая решетка.
Примерами веществ с ионной кристаллической решеткой являются оксид кальция CaO, оксид магния MgO, хлорид аммония NH4Cl, хлорид магния MgCl2, оксид лития Li2O и другие.
Примеры: NH
Все молекулы состоят из крошечных частиц — атомов. Все открытые на сегодняшний день атомы перечислены в периодической таблице.
Атом — это наименьшая химически неделимая частица материи, которая сохраняет свои химические свойства. Атомы соединены друг с другом химическими связями. Ранее мы рассмотрели типы химических связей и их свойства. Обязательно изучите теорию предмета: Типы химических связей перед изучением этой статьи!
Теперь давайте посмотрим, как частицы могут объединяться, образуя материю.
В зависимости от положения частиц по отношению друг к другу, свойства образуемых ими веществ могут быть очень разными. Таким образом, если частицы находятся очень далеко друг от друга (расстояние между частицами намного больше, чем сами частицы), почти не взаимодействуют друг с другом и хаотично и непрерывно перемещаются в пространстве, то мы имеем дело с газом.
Если частицы расположены близко друг к другу, но хаотично, сильнее взаимодействуют друг с другом, сильно колеблются в одном положении, но могут перескочить в другое положение, то мы имеем дело с моделью флюидной структуры.
Cl, хлорид магния Mg Cl
- небольшая твердость;
- низкая сила;
- плавкость;
- волатильность;
- некоторые имеют запах.
Большинство известных химических веществ и смесей могут существовать в твердом, жидком и газообразном состояниях. Самый простой пример — вода. При нормальных условиях он находится в жидком состоянии, при 0°C он замерзает — переходит из жидкого состояния в твердое, а при 100°C он закипает — переходит в газообразную фазу — водяной пар. В то же время многие вещества при нормальных условиях являются газообразными, жидкими или твердыми. Воздух, например, смесь азота и кислорода, при нормальных условиях является газом. Однако при высоком давлении и низкой температуре азот и кислород конденсируются и переходят в жидкую фазу. Жидкий азот используется в промышленности
Металлическая кристаллическая решетка
Электропроводность — это способность вещества проводить электричество.
Электричество — это равномерное движение заряженных частиц. Поэтому только вещества с движущимися заряженными частицами могут проводить электричество. Вещества делятся на проводники и диэлектрики в зависимости от их способности проводить электричество. Проводники — это вещества, которые могут проводить электричество (т.е. содержат движущиеся заряженные частицы). Диэлектрики — это вещества, которые практически не проводят электричество.
Существует три агрегатных состояния: твердое, жидкое и газообразное. Каждое из этих состояний требует определенного расположения частиц. Ниже более подробно описано, как в химии связаны кристаллическая решетка и агрегатное состояние вещества.
Большинство веществ могут существовать в твердом, жидком и газообразном состояниях и легко переходить из одного состояния в другое в зависимости от давления и температуры. Типичным примером является вода, которая при нагревании превращается в пар, а при охлаждении — в твердый лед.
- твердость;
- хрупкость;
- неплавкость;
- отсутствие волатильности;
- электропроводность;
- способность растворяться в воде.
Молекулярно-кинетическая теория


Строение и агрегатное состояние веществ
- Если частицы движутся хаотично и расстояние между ними во много раз превышает их собственные размеры, то это газ. Из-за большого расстояния друг от друга молекулы и атомы такого вещества слабо взаимодействуют друг с другом.
- Если частицы все же расположены хаотично, но на небольшом расстоянии друг от друга, это жидкость. В жидком состоянии вещества его молекулы и атомы имеют более прочные связи, которые труднее разорвать.
- Если частицы сближаются близко друг к другу и в определенном порядке, то это твердое тело. В этом состоянии связи между ними самые крепкие. Частицы могут двигаться только в пределах своего местоположения и почти не перемещаются в пространстве.