На практике используются оба типа катализаторов. Например, специальные органические катализаторы — ферменты — участвуют абсолютно во всех биохимических процессах: Переваривание пищи, сокращение мышц, дыхание. Без ферментов жизнь не могла бы существовать!
Скорость химической реакции, ее зависимость от различных факторов
Скорость химической реакции — это изменение количества одного из реагирующих веществ за единицу времени. Скорость химической реакции занимает разное количество времени при определенных условиях. Например, в водных растворах они движутся быстрее, чем на твердых поверхностях. Самые быстрые процессы происходят при взрыве газовых смесей. Понятие скорости реакции описывает изменение количества реактанта и продукта реакции за определенный период времени. В зависимости от условий, в которых протекает реакция, различают гомогенные и гетерогенные процессы.
Гомогенные реакции протекают в однородной среде: Газовые или водные. Взаимодействие реактантов происходит не избирательно, а по всему объему. Скорость этой реакции рассчитывается по формуле:
Δn : ΔtV = Vоднородный,
- n – обозначает разницу количества исходного (редко продукта) вещества в молях,
- t – временной отрезок, за который прошла реакция,
- V – объем газа.
Отношение химического количества вещества к его объему выражается как концентрация ∆c. Таким образом, формула имеет упрощенный вид:
Δc : Δt = vоднородный
Эта формула подходит для реакций, в которых все вещества находятся в одинаковом суммарном состоянии, например: Газы, жидкости.
Гетерогенные реакции характеризуются процессами, происходящими на поверхности контакта двух веществ, находящихся в различных агрегатных состояниях. Например, между газом и жидкостью, газом и твердым телом, жидкостью и твердым телом, двумя несмешивающимися жидкостями. Этот процесс характеризуется следующей формулой:
Δc : ΔtS = mol : s*m 2 = v гетерогенный, где.
- S – площадь соприкосновения реагентов,
- t – время, за которое протекает процесс,
- c – концентрация реагирующих веществ.
Расчет по формуле подвержен неопределенности. Процессы связаны с определенными условиями: температура, концентрация, площадь, катализатор. Если они изменяются, это влияет на скорость химической реакции.
Температура
Повышение температуры ускоряет химический процесс. Это изменение описывается правилом Вант-Гоффа, которое гласит:
- • Поднятие температуры на 10°С вызывает ускорение химической реакции в 2-4 раза. Скорость увеличивается с каждыми 10 единицами температуры.
Внутри пробирки молекулы не увеличивают свою подвижность из-за повышения температуры. Но они продолжают наваливаться друг на друга, чтобы процесс шел быстрее. Это правило описывается следующей формулой:
- vt1– исходная скорость реакции,
- vt2– конечная скорость процесса,
- у –коэффициент, который рассчитывается для каждой реакции,
- 10 – показывает увеличение на каждые 10°С.
Это правило действует не всегда, поскольку некоторые вещества могут испаряться при повышении температуры, а также распадаться или полностью разлагаться.
Экзотермические и эндотермические реакции
Экзотермические реакции сопровождаются выделением большого количества тепла. Процесс быстрый и простой. Все окислительно-восстановительные реакции выделяют много тепла. Это означает энергию и записывается как +Q.
Эндотермические реакции, с другой стороны, требуют большого количества энергии извне. Чтобы эти реакции произошли, реактивы нагревают в течение длительного времени. Они выполняются медленно и в течение длительного периода времени и пишутс я-Q.
Температура по-разному влияет на скорость в таких системах: в экзотермических реакциях скорость уменьшается при повышении температуры, а в эндотермических реакциях она увеличивается.
Скорость химической реакции
Скорость химической реакции является основным понятием x
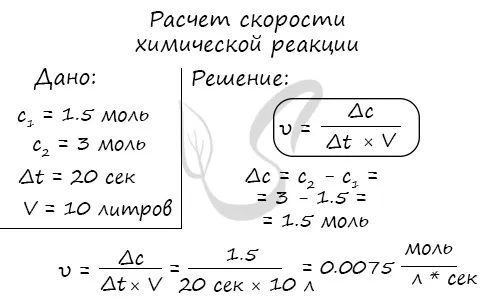
Мне попадались задачи, в которых были указаны молекулярная концентрация вещества до и после реакции, время и объем. Меня попросили рассчитать скорость реакции. Например, давайте решим аналогичную задачу:
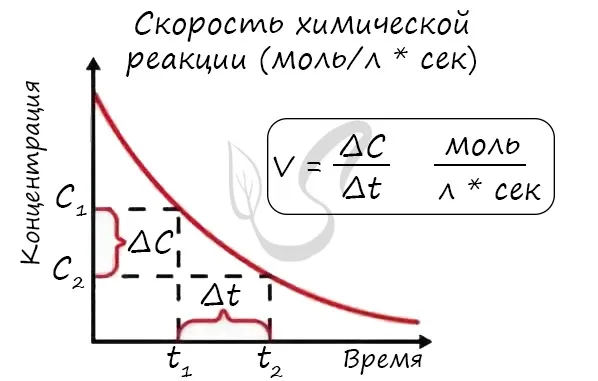
Молярная концентрация вещества до реакции составляла 1,5 моль/л, после реакции — 3 моль/л. Объем смеси составляет 10 литров, а реакция заняла 20 секунд. Рассчитайте скорость реакции.
Влияние типа реактивов
При изучении состояния вещества возникает вопрос: где реакции протекают быстрее всего: между газами, растворами или твердыми телами?
Помните, что самая быстрая скорость реакции происходит между растворами, т.е. в жидкостях. С газами это происходит несколько медленнее.
Если это гетерогенная реакция (жидкость + твердое тело, газообразное + твердое тело, жидкость + газообразное), то площадь контакта реактантов играет важную роль.

Очевидно, что большое количество железа, помещенное в соляную кислоту, реагирует гораздо дольше, чем измельченное железо — железные опилки.
Химическая активность также играет важную роль. Например, отвечая на вопрос «Какой металл, Fe или Ca, быстрее реагирует с серой?», мы отдадим предпочтение кальцию, потому что он находится слева от железа в порядке активности металлов, поэтому кальций более активен, чем железо.

Реакции металлов с водой требуют другого подхода, где необходимо учитывать радиус атома. Например, отвечая на вопрос «Какой металл, Li или K, быстрее реагирует с водой?», мы предпочтем калий, потому что у калия больше атомный радиус. Калий реагирует с водой быстрее, чем литий.

Иногда для правильного ответа на вопрос о скорости реакции требуются знания об активности кислот. Более подробно мы обсудим эту тему в разделе гидролиз, а пока хотелось бы отметить: Чем сильнее (активнее) кислота, тем быстрее протекает реакция.
Например, реакция магния с серной кислотой протекает гораздо быстрее, чем реакция магния с уксусной кислотой. Причина этого в том, что серная кислота является сильной (активной) кислотой, тогда как уксусная кислота менее активна, поскольку является слабой кислотой.
Как я уже упоминал ранее, слабые и сильные кислоты и основания изучаются в Гидролизе.
Эффекты изменения концентрации
Влияние концентрации «прямо пропорционально» скорости реакции: если концентрация реактива увеличивается, скорость реакции увеличивается, если уменьшается — уменьшается.
Я хотел бы обратить внимание на одну деталь, которая может быть важной, когда в реакции участвуют газы: При увеличении давления концентрация вещества в единице объема увеличивается (представьте себе сжимаемый газ). Поэтому увеличение давления при наличии газа между исходными веществами увеличивает скорость реакции.
Также можно изменить количество фактических столкновений, изменяя концентрацию реагирующих веществ. Понятие концентрации обычно используется для газов и жидкостей, поскольку в газах и жидкостях частицы быстро перемещаются и активно перемешиваются. Чем выше концентрация реагирующих веществ (жидкостей, газов), тем больше число фактических столкновений и тем выше скорость химической реакции.
Концентрация
Основываясь на большом количестве бывших
Для химической реакции вида: aA + bB = cC + dD, закон действующих масс записывается следующим образом:
Где v — скорость химической реакции,
и C
— концентрация веществ A и B соответственно, моль/л
CAk — коэффициент пропорциональности, константа скорости реакции.BНапример, для реакции образования аммиака:
Закон действующих масс выглядит следующим образом:
Константа скорости реакции k показывает скорость реакции веществ, когда их концентрация равна 1 моль/л или их продукт равен 1. Константа скорости химической реакции зависит от температуры и не зависит от концентрации реагирующих веществ.
Закон действующих масс не учитывает концентрацию твердых частиц, так как они обычно реагируют на поверхности и количество реагирующих частиц на единицу площади не меняется.
В большинстве случаев химическая реакция состоит из множества простых этапов, поэтому уравнение химической реакции представляет собой только общее или конечное уравнение происходящих процессов. В этом случае скорость химической реакции может зависеть (или не зависеть) от концентрации реагирующих веществ, промежуточных продуктов или катализатора, поэтому точная форма кинетического уравнения определяется экспериментально или на основе анализа предполагаемого механизма реакции. Как правило, скорость сложной химической реакции определяется скоростью самого медленного этапа (лимитирующего этапа).
Концентрация газов напрямую связана с давлением. Если давление увеличивается, концентрация газов возрастает. Математическим выражением этой зависимости (для идеального газа) является уравнение Менделеева-Клапейрона:
pV = nRT
Давление
Таким образом, если между реактантами находится газообразное вещество, скорость химической реакции увеличивается при повышении давления и уменьшается при его снижении.
Например. Как изменяется скорость реакции при плавлении извести с кремнеземом?
при повышении давления?
Правильный ответ — нет, поскольку реактивы не содержат газов, карбонат кальция — твердая, нерастворимая в воде соль, а кремнезем — твердое вещество. Полученный газ будет являться продуктом — углекислым газом. Однако продукты не влияют на скорость прямой реакции.
Другой способ увеличить скорость химической реакции — направить ее иначе, например, заменив прямое взаимодействие между веществами A и B серией последовательных реакций с третьим веществом K, которые требуют гораздо меньше энергии (имеют более низкий барьер энергии активации) и протекают быстрее, чем прямая реакция в данных условиях. Это третье вещество называется катализатором.
Катализаторы — это химические
Катализатор
При гетерогенном катализе реактанты и катализатор находятся в разных фазах. Гетерогенные катализаторы обычно представляют собой твердые вещества. Поскольку взаимодействие в этих катализаторах происходит только на поверхности вещества, важным условием для катализаторов является большая площадь поверхности. Гетерогенные катализаторы характеризуются высокой пористостью, что увеличивает площадь поверхности катализатора. Например, общая площадь поверхности некоторых катализаторов иногда достигает 500 квадратных метров на 1 г катализатора. Большая площадь поверхности и пористость обеспечивают эффективное взаимодействие с реагентами. К гетерогенным катализаторам относятся металлы, цеолиты — кристаллические минералы группы алюмосиликатов (соединения кремния и алюминия) и другие.
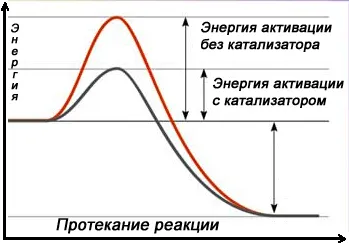
Примером гетерогенного катализа является синтез аммиака:
В качестве катализатора используется пористое железо с Al
и K
Сам катализатор не расходуется в ходе химической реакции, но на поверхности катализатора накапливаются другие вещества, которые связываются с активными центрами катализатора и препятствуют его работе (яды катализатора). Их необходимо регулярно удалять путем регенерации катализатора.
Ферментные катализаторы оказываются очень эффективными в биохимических реакциях. Ферментные катализаторы работают эффективно и избирательно, селективность составляет 100 %. К сожалению, ферменты очень чувствительны к повышению температуры, кислотности среды и другим факторам, поэтому существуют определенные ограничения для применения процессов ферментного катализа в промышленных масштабах.
Можно говорить о целесообразности процесса, изменяя энергию Гиббса системы. Однако эта величина не отражает реальную возможность, механизм и скорость химической реакции.
Чтобы полностью представить химическую реакцию, необходимо знать временные законы реакции, т.е. скорость химической реакции и ее детальный механизм.

Определите скорость химической реакции:
Скорость химической реакции — это изменение концентрации реагирующих веществ за единицу времени.2O3Скорость и механизм реакции изучаются в химической кинетике — науке о химических процессах.2O.
С точки зрения химической кинетики, реакции можно разделить на простые и сложные.
Простые реакции — это процессы, которые протекают без образования промежуточных продуктов. В зависимости от числа участвующих частиц их можно разделить на унимолекулярные, бимолекулярные и тримолекулярные реакции. Столкновение более чем трех частиц маловероятно, поэтому тримолекулярные реакции довольно редки, а тетрамолекулярные неизвестны.
Скорость химической реакции
Сложные реакции — это процессы, состоящие из множества элементарных реакций.
Каждый процесс протекает с определенной скоростью, которую можно определить по изменениям за определенный период времени.
Средняя скорость химической реакции выражается изменением количества вещества n, потребленного или поглощенного в единице объема V за единицу времени t. Средняя скорость химической реакции выражается изменением количества вещества n, потребленного или поглощенного в единице объема V за единицу времени t.
Если вещество расходуется, поставьте знак «-«; если накапливается, поставьте знак «+».
Для постоянного объема:
Единицей скорости реакции является моль/л-с.
В общем случае u является константой и не зависит от вещества, участвующего в реакции.
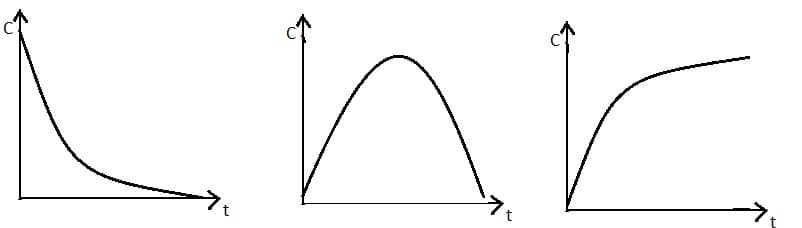
Зависимость концентрации реагента или продукта от времени реакции представлена в виде кинетической кривой вида u:
Расчет u по экспериментальным данным упрощается, если вышеприведенные выражения преобразовать в следующее выражение:
u = — ΔC/Δt моль/л-с
Формулировка закона реальных масс выглядит следующим образом:
Скорость гомогенной элементарной химической реакции прямо пропорциональна произведению концентраций реагирующих веществ.
То есть скорость прямой химической реакции зависит от концентраций исходных веществ.
Если исследуемый процесс представлен в форме:
a A + b B = продукция
то скорость химической реакции может быть выражена кинетическим уравнением:
| a и b — стехиометрические коэффициенты простой реакции, |
Закон действующих масс. Порядок и константа скорости реакции
k — константа скорости реакции.
Химический смысл значения константы скорости реакции k — это скорость реакции при единичных концентрациях.
То есть, если концентрации веществ A и B равны 1, то u = k.
Следует помнить, что в сложных химических процессах коэффициенты a и b не совпадают со стехиометрическими коэффициентами.
Закон действующих масс выполняется при определенных условиях:
Закон массового действия не может быть применен к сложным процессам!
Это можно объяснить тем, что сложный процесс состоит из множества элементарных стадий и его скорость определяется не суммарной скоростью всех стадий, а только самой медленной стадией, которая называется предельной.
Каждая реакция имеет свой порядок. Определяется частичный (парциальный) порядок реактива и общий (суммарный) порядок.
Например, при выражении скорости химической реакции для процесса
a A + b B = продукция
a — порядок реактива A
Для простых процессов порядок реакции дает число реагирующих частиц (которые согласуются со стехиометрическими коэффициентами) и принимает целочисленные значения.
- Реакция активируется термично, т.е. энергией теплового движения молекул.
- Концентрация реагентов распределена равномерно.
- Свойства и условия среды в ходе процесса не меняются.
- Свойства среды не должны влиять на k .
Для сложных процессов порядок реакции не совпадает со стехиометрическими коэффициентами и может быть произвольным.
Определим факторы, влияющие на скорость химической реакции u:
1. зависимость скорости реакции от концентрации реагирующих веществ.
Скорость реакции определяется законом действующих масс:
Очевидно, что при увеличении концентрации реагирующих веществ скорость реакции u возрастает, поскольку увеличивается число столкновений между веществами, участвующими в химическом процессе.
Кроме того, важно учитывать порядок реакции:
Если n = 1 для реактива, то его скорость прямо пропорциональна концентрации этого вещества.
Если n = 2 для любого реактива, то удвоение его концентрации приводит к увеличению скорости реакции в 2 раза = 4.
Факторы, влияющие на скорость химической реакции
Увеличение концентрации на 3 ускоряет реакцию на 3 2 = 9.
2. взаимосвязь между скоростями реакций
Поэтому химические процессы между веществами в растворенном, жидком или газообразном состоянии протекают быстрее, чем взаимодействия между твердыми телами.
4. зависимость скорости реакции от типа вещества.
В этом случае большое значение имеет структура электронной оболочки атома, тип химических связей и их прочность в молекулах, структура вещества и прочность его решетки.
Например, натрий более активно реагирует с водой, чем олово. Поэтому скорость взаимодействия натрия с водой выше, чем скорость взаимодействия олова с водой. 5.
5 Взаимосвязь между скоростью реакции и температурой
определяется правилом Вант-Гоффа и уравнением Аррениуса.
Повышение температуры добавляет энергию молекулам (тем самым увеличивая энергию активации), что способствует протеканию реакции.
Таким образом, при повышении температуры скорость химической реакции увеличивается.
В 1889 году Сванте Аррениус исследовал зависимость скорости реакции u от температуры и обнаружил, что большинство химических процессов подчиняются уравнению:
Где k — константа скорости реакции.
Термин «ставка» довольно широко используется в литературе. Из физики известно, что чем большее расстояние проходит материальное тело (человек, поезд, космический корабль) за определенное время, тем больше его скорость.
Но как можно измерить скорость химической реакции, которая никуда не идет и не преодолевает никакого расстояния? Чтобы ответить на этот вопрос, нам нужно знать, что всегда меняется в любой химической реакции. Поскольку каждая химическая реакция — это процесс превращения вещества, исходное вещество реакции исчезает и превращается в продукты реакции. Поэтому в химической реакции количество вещества всегда меняется, число частиц исходного вещества уменьшается, как и его концентрация (C).
ИСПОЛЬЗОВАНИЕ РАБОТЫ. Скорость химической реакции пропорциональна изменению:
Теперь сравните свой ответ с правильным ответом:
Скорость химической реакции равна изменению концентрации реагирующего вещества в единицу времени.
Где C
и C
— Концентрации реактантов, конечная и начальная концентрации соответственно; t
и t
— Время эксперимента, конечный и начальный период, соответственно.
Поскольку реактивы всегда расходуются в данной реакции, это означает.
Поэтому отношение этих величин всегда отрицательно, а скорость не может быть отрицательной величиной. Поэтому в формуле появляется знак минус, который в то же время говорит, что скорость любой реакции всегда уменьшается со временем (при постоянных условиях).
Поэтому скорость химической реакции равна :
Возникает вопрос, в каких единицах следует измерять концентрацию реактивов (C) и почему? Чтобы ответить на этот вопрос, нужно понять, что является основным условием любой химической реакции.
Чтобы частицы вступили в реакцию, они должны, по крайней мере, столкнуться. Поэтому чем больше количество частиц* (количество молекул) на единицу объема, тем чаще они сталкиваются, тем выше вероятность химической реакции.
* Вы можете узнать, что такое крот в уроке 29.1.
Поэтому при измерении скорости химических процессов используют молекулярную концентрацию веществ в реагирующих смесях.
Молярная концентрация вещества показывает, сколько молекул этого вещества содержится в 1 литре раствора.
Урок 5. Скорость химической реакции
Поэтому чем выше молекулярная концентрация реагирующих веществ, тем больше частиц в объеме, тем чаще они сталкиваются, тем выше (при прочих равных условиях) скорость химической реакции. Поэтому фундаментальным законом химической кинетики (науки о скорости химических реакций) является закон эффективных масс.
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ.
Для такой реакции, как A + B → … этот закон можно выразить математически следующим образом:
- концентрации вещества в единицу времени;
- количеству вещества в единице объёма;
- массы вещества в единице объёма;
- объёму вещества в ходе реакции.
Если реакция более сложная, например, 2A + B → или, что то же самое, A + A + B → …, то.
Таким образом, в уравнении скорости появляется экспонента степени «два», что соответствует коэффициенту 2 в уравнении реакции. В более сложных уравнениях экспоненты большой степени обычно не используются. Это объясняется тем, что вероятность одновременного столкновения, например, трех молекул A и двух молекул B крайне мала. Поэтому многие реакции протекают в несколько фаз, в которых сталкиваются не более трех частиц, и каждая фаза процесса протекает с определенной скоростью. Эта скорость и уравнение кинетической скорости для нее определены экспериментально.
* ЛЕ ШАТЕЛЬЕ Анри Луи (8.10.1850-17.09.1936) — французский физико-химик и металлограф. Он сформулировал общий закон равновесного смещения (1884).1Реакции могут быть как обратимыми, так и необратимыми.0Необратимые реакции — это реакции, в которых не существует условий, при которых возможно обратное развитие процесса.1Такие реакции возникают, например, когда молоко прокисает или когда вкусная котлета подгорает. Как нельзя пропустить фарш обратно через мясорубку, чтобы получить кусок мяса, так нельзя «разогреть» котлету или сделать свежее молоко.2Однако мы должны задать себе простой вопрос: Является ли этот процесс необратимым?
Чтобы ответить на этот вопрос, следует вспомнить, можно ли осуществить обратный процесс. Да! Разложение известняка (мела) для получения извести CaO используется в промышленных масштабах:
Таким образом, реакция является обратимой, поскольку существуют условия, при которых оба процесса протекают с заметной скоростью:
Существуют также условия, при которых скорость прямой реакции равна скорости обратной реакции.
В этих условиях устанавливается химическое равновесие. В этот момент реакция не останавливается, но количество образовавшихся частиц равно количеству распавшихся частиц. Поэтому в состоянии химического равновесия концентрации реагирующих частиц не изменяются. Например, для нашего процесса в момент химического
Очевидно, что этот процесс происходит за счет уменьшения числа молекул газа, поэтому давление в прямой реакции снижается. При обратной реакции, напротив, давление в смеси увеличивается.
Давайте спросим себя, что произойдет, если мы увеличим давление в этой системе? Согласно принципу Ле Шателье, реакция, которая «делает все наоборот», заключается в уменьшении давления. Это прямая реакция: меньше молекул газа — меньше давление.
Поэтому если давление увеличивается, равновесие смещается в сторону прямого процесса, где давление уменьшается, если уменьшается число молекул газа.
ИСПОЛЬЗОВАНИЕ РАБОТЫ. При увеличении давления равновесие в системе смещается вправо:
Если в результате реакции число молекул газа не меняется, то изменение давления не влияет на положение равновесия.
Скорость химической реакции зависит от:
Равновесие достигается, когда скорость прямой реакции равна скорости обратного процесса. В этом случае равновесная концентрация реактантов не изменяется. Состояние химического равновесия зависит от условий и подчиняется принципу Ле Шателье.
Обратимость химических процессов. Принцип Ле-Шателье

Выводы
- природы реагирующих частиц;
- концентрации или площади поверхности раздела реагирующих веществ;
- температуры;
- наличия катализатора.