Самое сложное — выяснить, сколько атомов каждого атома находится в соединении. Имеется три атома кальция, два атома фосфора и восемь атомов кислорода. Как вы к этому пришли? Если часть соединения приведена в скобках, умножьте подстрочный индекс сразу после символа элемента на подстрочный индекс, закрывающий скобки.
Урок 7. Относительная молекулярная и относительная формульная массы
В уроке 7 «Относительная молекулярная масса и относительная типовая масса» из книги «Химия для чайников» мы узнаем, как рассчитать относительную молекулярную массу и относительную типовую массу веществ, а также узнаем, что такое массовая доля и приведем формулу для ее расчета. Помните, что на прошлом уроке «Валентность» мы дали определение валентности и научились ее определять; мы рассмотрели элементы с постоянной и переменной валентностью и научились составлять химические формулы в зависимости от валентности.

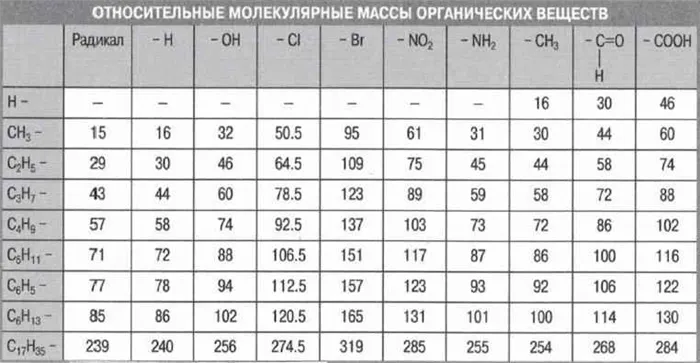
Каждый химический элемент характеризуется определенным значением относительного атомного веса. Состав вещества выражается молекулярной или простой формулой его структурной единицы. Такая структурная единица состоит из определенного количества атомов химического элемента. Поэтому масса структурной единицы может быть выражена в единицах атомной массы.
Относительная молекулярная масса
Вещества с молекулярной структурой характеризуются их относительной молекулярной массой, которая обозначается буквой М.r.
Относительная молекулярная масса — это физическая величина, которая соответствует отношению массы молекулы вещества к 1/12 массы атома углерода.
Эта величина равна сумме относительных атомных масс всех химических элементов с учетом числа их атомов в молекуле. Например, рассчитаем относительную молекулярную массу воды H2O:

Относительная молекулярная масса серной кислоты H2SO4:
Относительные молекулярные веса, как и относительные атомные веса, являются безразмерными величинами. Значение Mrпоказывает, как часто масса молекулы определенного вещества больше атомной единицы массы u. Например, если Mr(H2O) = 18, что означает, что масса H2Молекула O имеет массу в 18 раз больше 1/12 массы атома углерода, т.е. в 18 раз больше атомной единицы массы. Следовательно, масса H2SO4в 98 раз больше, чем 1/12 массы атома углерода.
Относительная формульная масса
Вещества с немолекулярной структурой также характеризуются аналогичной величиной, которая называется относительной массой формулы. Как и относительная молекулярная масса, она равна сумме относительных атомных масс всех элементов, образующих структурную единицу этих веществ — формульную единицу, и также обозначается Mr. В этом случае, конечно, необходимо учитывать индексы в атомных символах.
Например, относительная формульная масса вещества CaCO3равна:

Относительная стандартная масса вещества Al2(SO4)3равна:
Относительная стандартная масса показывает, во сколько раз масса стандартной единицы данного вещества больше 1/12 массы атома углерода или атомной единицы массы u .
Понятие атомной единицы массы
В настоящее время принято считать, что масса в единице массы или единице атомного номера — это масса одного атома или единицы атомного номера.
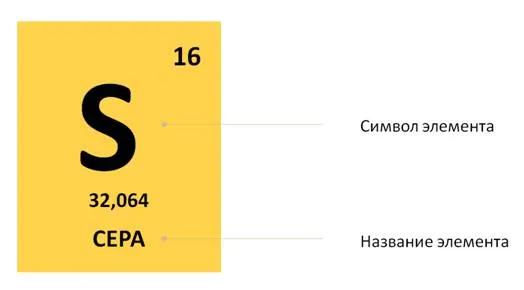
Атомная масса показывает, какую массу имеет атом. Его можно найти в таблице Менделеева. Как правило, масса в этой таблице приводится в виде дробного числа, которое очень близко к целочисленному значению. Например, атомная масса водорода составляет 1,000797 а.е.м., гелия — 4,0026 а.е.м., а кислорода — 15,9994 а.е.м.. В практических приложениях обычно округляют эти значения до целых чисел. В практических задачах принято устанавливать атомную массу водорода на уровне 1 AU, гелия — 4 AU и кислорода — 16 AU. Исключением является хлор, масса которого округляется до 35,5 AU.
Важно понимать, что атомы одного и того же элемента могут иметь разную массу. Такие вещества с разной атомной массой называются изотопами. Изотопы одного и того же элемента имеют одинаковое количество протонов, но разное количество нейтронов. Однако все изотопы одного и того же элемента обладают одинаковыми химическими свойствами.
Матрица Менделеева дает средний вес всех изотопов с учетом их обилия в природе. Кислород, например, имеет три стабильных изотопа:
- кислород-16 (масса 15,9949 а. е. м, распространенность 99,759%)
- кислород-17 (масса 16,9991 а. е. м., распространенность 0,037%)
- кислород-18 (масса 17,9991 а. е. м., распространенность 0,204%)
Исходя из этого, атомный вес кислорода, приведенный в таблице Менделеева, рассчитывается следующим образом:
(15,9949-99,759 + 16,9991-0,037 + 17,9991-0,204)/100 = 15,9994 а.е.
Молекулярная масса
Если вы знаете атомные веса отдельных элементов, вы также можете определить молекулярные веса молекул. Для этого достаточно сложить атомные веса атомов, входящих в состав молекулы.
Возьмем, к примеру, молекулу метана, имеющую формулу CH4что означает, что он состоит из 1 атома углерода (с массой 12 уе) и 4 атомов водорода (с массой 1 уе каждый). Добавьте атомные массы:
12 + 1 + 1 + 1 + 1 + 1 + 1 = 12 + 4-1 = 16 уе.
Поэтому молекула метана имеет молекулярную массу 16 а.е.м.
Обратите внимание, что очень часто возникает путаница относительно молекул простых газов — водорода, кислорода, азота и т.д. Это происходит потому, что их молекулы состоят из двух атомов, поэтому их масса вдвое больше массы их атомов. Например, атомный вес элемента кислорода составляет 16 уе, но молекула кислорода с формулой O2который имеет формулу O, весит 16 — 2 = 32.
Молярная масса
Молекулярные веса веществ тесно связаны с понятием молекулярной массы. Молекулярная масса — это масса 1 моль вещества. Численно это то же самое, что и молекулярный вес, но измеряется он в других единицах — граммах на молекулу или г/моль.
Молекулярная масса может быть использована для определения того, легче или тяжелее газ, чем воздух. Мы просто должны сравнить молекулярную массу газа с молекулярной массой воздуха, которая составляет 28,98 г/моль. Поэтому кислород тяжелее воздуха, так как его молекулярная масса составляет 32 г/моль. С другой стороны, азот легче воздуха, поскольку его молекулярная масса составляет 28 г/моль. Здесь следует уточнить
п.3. Молярная масса
Молярная масса – это масса 1 моля вещества. Из определения 1 моля вещества и относительной молекулярной массы следует, что молярная масса равна $ \mu=M_r\cdot 10^\frac>>$
Например: Молярная масса воды $ \mu(\mathrm)=M_r(\mathrm)\cdot 10^=18\cdot 10^\frac>>$
Алгоритм определения молярной массы вещества с помощью таблицы Менделеева Шаг 1. По таблице Менделеева найти относительные атомные массы \(A_\) для всех элементов, входящих в молекулу вещества. Шаг 2. Найти относительную молекулярную массу как сумму всех относительных атомных масс $ M_r=\sum_i A_ $ Шаг 3. Записать молярную массу в виде $ \mu=M_r\cdot 10^\frac>>$
Например: Найдем молярную массу этилового спирта \begin A_r(\mathrm)=12,\ A_r(\mathrm)=1,\ A_r(\mathrm)=16\\ M_r(\mathrm)= 2A_r(\mathrm)+6A_r(\mathrm) +A_r(\mathrm)=2\cdot 12+6\cdot 1+16=46\\ \mu(\mathrm)=46\cdot 10^\frac>>Задача 1. Масса кристалла серы равна 16 г. Сколько молекул серы содержится в этом кристалле? (Округлите ответ до двух значащих цифр).
п.4. Молярный объем
$ Количество вещества в кристалле серы: $<\mu>u=\frac=\frac.<\mu>$
$ Число молекул в кристалле серы: $ N=\frac<\mu\ \text<газ>>=22,4\frac>>$
N_A $ $ N=\frac
п.5. Задачи
\cdot 6,022\cdot 10^\\\approx 3,8\cdot 10^ $ Ответ : \(3.8\cdot 10^\).
Относительная молекулярная масса одной молекулы $ M_r=8\cdot A_r=8\cdot 32=256 $ Молярная масса $ \mu=256\cdot 10^\frac>>Проблема 2*. Генератор кислорода космического корабля произвел 1,6 кг кислорода \(\mathrm\). Обычно космонавту требуется 600 литров кислорода в день. Предполагая, что газовые условия приблизительно нормальные, определите, сколько часов астронавт получал кислород.<\mu>$ Объем полученного кислорода $<\mu>u=\frac=\frac<1,6\cdot 10^><256\cdot 10^>$ Объем произведенного кислорода $ V=\frac
=V_
Относительная молекулярная масса молекулы кислорода $ M_r=2\cdot A_r=32 $ Молярная масса кислорода $ \mu=32\cdot 10^\frac>>$ количество часов, в течение которых атом дышит \begin t=\frac=\frac