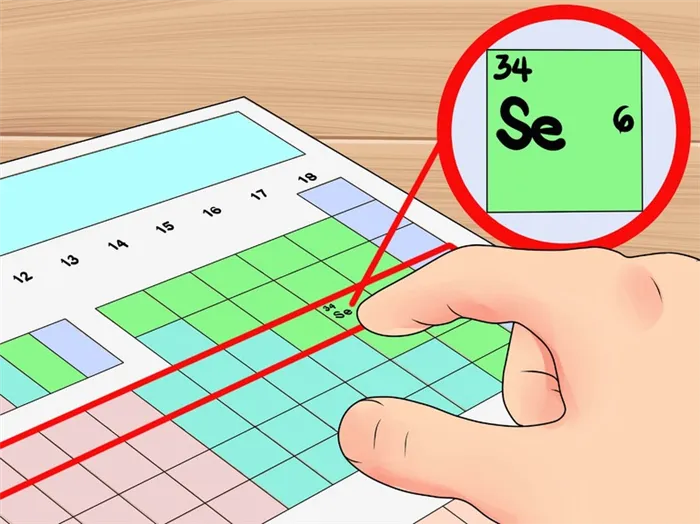
Для образования бинарных соединений элементов достаточно определить их валентность. Если нужно написать формулу хлорида кислорода ClO, в котором валентность Cl равна 7, то соблюдается следующий порядок:
Валентность
Валентность (от лат. v alēns «иметь силу») — это способность атомов химических элементов образовывать определенное количество химических связей с атомами других элементов.
- 1 История возникновения понятия «валентность»
- 2 Современные представления о валентности
- 3 См. также
- 4 Примечания
- 5 Ссылки
- 6 Литература
История возникновения понятия «валентность»
Этимология термина валентность восходит к 1425 году, когда он впервые был использован в научных текстах в значении «экстракт» или «подготовка». Его использование в контексте современного определения засвидетельствовано в 1884 году (нем.: Valenz ). 1 В 1789 году Уильям Хиггинс опубликовал работу, в которой утверждал о существовании связей между мельчайшими частицами материи. 2

Эдвард Франкленд — основатель современных ценностей
Однако более точное и впоследствии полностью подтвержденное понимание явления валентности было предложено в 1852 году химиком Эдвардом Франклендом в работе, в которой он обобщил и переосмыслил все существовавшие на тот момент теории и спекуляции на эту тему. Наблюдая насыщаемость различных металлов и сравнивая состав органических производных металлов с составом неорганических соединений, Франкланд ввел понятие «связность» и тем самым заложил основы теории валентности. Хотя Франкленд установил некоторые конкретные законы, его идеи не получили дальнейшего развития.
Фридрих Август Кекуле сыграл ключевую роль в развитии теории валентности. В 1857 году он показал, что углерод является четырехатомным элементом, а его простейшее соединение метан CH4. Убедившись в истинности своих идей о валентности атомов, Кекуле включил их в свой учебник органической химии: По мнению автора, валентность — это фундаментальное свойство атома, такое же фиксированное и неизменное, как атомный вес. В 1858 году Арчибальд Скотт Купер высказал идеи, почти идентичные идеям Кекуле, в своей статье «О новой химической теории».
Три года спустя, в сентябре 1861 года, А. М. Бутлеров представил важные дополнения к теории валентности. Он провел четкое различие между свободным индивидом и индивидом, вступившим в связь с другим индивидом, когда родство «связывает и переходит в новую форму». Бутлеров ввел понятие полного использования сил сродства и «напряженности сродства», т.е. энергетического неравенства связей, обусловленного взаимным влиянием атомов молекулы. В результате этого взаимного влияния атомы приобретают различные «химические значения» в зависимости от их структурного окружения. Теория Бутлерова позволила провести множество экспериментов
С момента появления теории химической связи понятие «валентность» претерпело значительную эволюцию. В настоящее время он не имеет строгой научной интерпретации, поэтому почти полностью вытеснен из научного лексикона и используется в основном в методологических целях.
Современные представления о валентности
Координационная модель образования ковалентной связи в молекуле ENT.
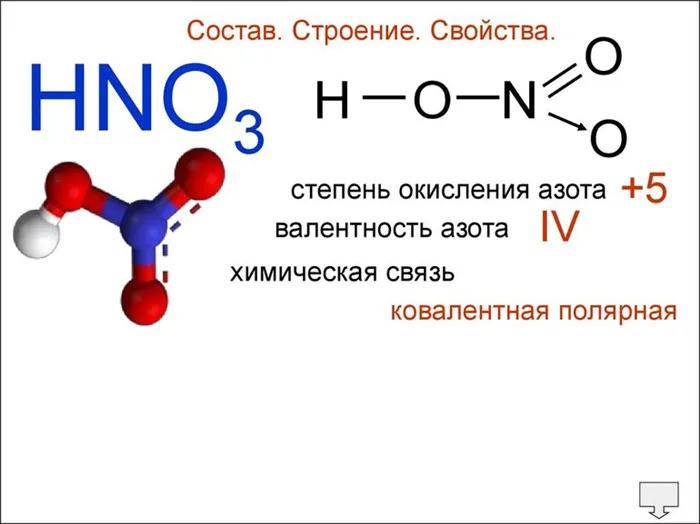
В целом, валентность химических элементов понимается как способность их свободных атомов образовывать определенное количество ковалентных связей. В соединениях с ковалентными связями валентность атомов определяется количеством двухэлектронных связей, образованных с двумя центрами. Именно такой подход использовался в теории валентных связей, предложенной В. Хайтлером и Ф. Лондоном в 1927 году. Если в атоме имеется n неспаренных электронов и m неспаренных электронных пар, то этот атом может образовывать n + m ковалентных связей с другими атомами.4 При оценке валентного максимума необходимо исходить из электронной конфигурации гипотетического, так называемого «возбужденного» (валентного) состояния. Так, максимальная валентность атома бериллия, бора или азота равна 4 (например, в Be(OH)3
2-, BF4— и NH4+ ), фосфор 5 (PCl4), сера 6 (H5), хлор 7 (Cl2SO4В некоторых случаях валентность отождествляется с характеристиками молекулярной системы, такими как степень окисления элемента, эффективный заряд атома, координационное число атома и т.д. Эти характеристики могут быть близкими или даже количественно одинаковыми, но они ни в коем случае не идентичны.5 Например, изоэлектронные характеристики молекул не идентичны. Например, в изоэлектронных молекулах азота N2O7).

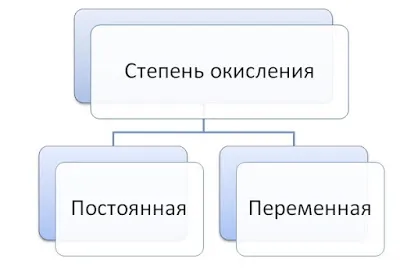
, монооксид углерода CO и цианид-ион CN — находятся в тройной связи (т.е. валентность каждого атома равна 3), но степени окисления элементов равны 0, +2, -2, +2 и-3 соответственно. В молекуле этана (см. рисунок) углерод четырехвалентен, как и в большинстве органических соединений, и степень окисления обычно равн а-3.2Это особенно верно для молекул с депротонированными химическими связями; в азотной кислоте, например, степень окисления азота равна +5, а азот не может иметь валентное состояние выше 4. Известное из многих учебников правило — «Максимальная валентность элемента численно равна номеру группы в периодической таблице» — относится исключительно к состоянию окисления. Термины «постоянная валентность» и «переменная валентность» также относятся в основном к состоянию окисления.
Семиполярные связи и донорно-реципиентные связи по своей сути являются «двойными» связями, поскольку при их образовании происходят оба процесса: Перенос электронов (образование ионной связи) и обмен электронами (образование ковалентной связи).
Концепция валентности не может быть использована в слишком большом количестве случаев, когда невозможно применить модель бицентрической двухэлектронной связи 6. Понятие валентности неприменимо для описания кластерных соединений, гидридов бора, карборанов, p-комплексов, соединений благородных газов и многих других. Например, катионы щелочных металлов в комплексах с краун-эфирами имеют валентность гораздо выше, чем их степень окисления.
Представьте на мгновение, если бы атомы не могли быть соединены вместе, как бы выглядела планета и как бы звучал вопрос: «Существовала ли вообще Солнечная система?». Поскольку атомы соединены между собой, вещества существуют, и мы тоже.
Валентность
Возвращаясь к деталям, мы сравним их с атомами, а их внешний вид — с количеством связей, которые они могут образовывать.
Давайте представим, что эта информация нам доступна.
Валентность элементов определяется количеством неспаренных электронов во внешнем слое.
Они объединены в семейство щелочных металлов, поскольку все они реагируют с водой с образованием щелочей — семейство MeOH. Формула внешнего слоя имеет вид ns 1. Если провести параллель с данными производителя, то они выглядят следующим образом.
Они могут отличаться по цвету и форме, но их объединяет количество соединений, которые они могут образовывать. Другими словами, щелочные металлы являются моновалентными.
Это правило распространяется и на элементы группы II, только они имеют вид двойных частей.
Если учесть, что элементы этой группы имеют формулу ns 2, то приходишь к выводу, что валентность атомов численно равна II.
Как вы, возможно, заметили или помните из темы о строении атома, высшая валентность определяется номером группы, но это не всегда одно и то же. Исключением из этого правила являются атомы таких элементов, как азот, фтор и кислород.
Для фтора, который относится к VII группе, валентная постоянная равна единице. Для других его родственников он был бы равен I, III, V или даже VII.
Источник
Давайте сыграем с вами в старую добрую игру «найди … отличия». Хотя они принадлежат к одной группе, у них одинаковая формула внешнего слоя ns 2 np 5, но валентность у них разная. Атомы хлора имеют свободную 3d плоскость, в которую при определенных условиях могут мигрировать электроны из внешнего слоя, создавая 3 возбужденных состояния. Атом фтора беден в этом отношении, у его электронов нет доступных d-орбиталей, его электронам некуда мигрировать. Поскольку он имеет только 1 несвязанный электрон, он может образовать только одну связь.
Обычно большинство элементов имеют разную валентность. Но для некоторых она будет постоянной. Некоторые уже известные вам элементы, такие как кислород и цинк, всегда двухвалентны, а алюминий имеет номер связи III.
Причины постоянной и переменной валентности
Положение элементов в периодической таблице показывает, сколько связей они могут образовывать.
Источник

Давайте сыграем с вами в старую добрую игру «найди … отличия». Хотя они принадлежат к одной группе, у них одинаковая формула внешнего слоя ns 2 np 5, но валентность у них разная. Атомы хлора имеют свободную 3d плоскость, в которую при определенных условиях могут мигрировать электроны из внешнего слоя, создавая 3 возбужденных состояния. Атом фтора беден в этом отношении, у его электронов нет доступных d-орбиталей, его электронам некуда мигрировать. Поскольку он имеет только 1 несвязанный электрон, он может образовать только одну связь.
Определение валентности элементов по формулам
Запах этого газа очень сильный, и его трудно забыть. Если вы когда-нибудь чувствовали запах аммиака, он поможет вам прийти в себя после обморока.3Источник
Давайте сыграем с вами в старую добрую игру «найди … отличия». Хотя они принадлежат к одной группе, у них одинаковая формула внешнего слоя ns 2 np 5, но валентность у них разная. Атомы хлора имеют свободную 3d плоскость, в которую при определенных условиях могут мигрировать электроны из внешнего слоя, создавая 3 возбужденных состояния. Атом фтора беден в этом отношении, у его электронов нет доступных d-орбиталей, его электронам некуда мигрировать. Поскольку он имеет только 1 несвязанный электрон, он может образовать только одну связь.
вы сталкиваетесь на кухне, когда включаете газовый кран для приготовления пищи. На самом деле метан не имеет запаха, но поскольку он считается взрывоопасным веществом, в него добавляют специальные пахучие вещества, чтобы его можно было обнаружить в случае утечки.4H
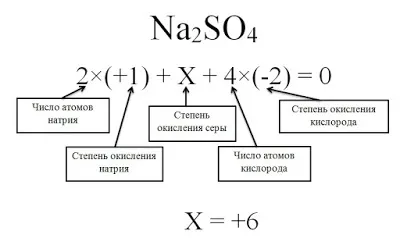
Молекула O находится вокруг нас. Все эти соединения содержат атомы водорода, только в разных количествах. Давайте попробуем найти ст.2. На каждые два атома фосфора приходится пять атомов кислорода. Кислород имеет постоянную валентность, которая равна II. Чтобы определить валентность фосфора, необходимо выполнить следующие математические действия.
Существуют определенные соединения, для которых необходимо определить валентность радикалов, входящих в состав кислот. Например, соединение Mg
(PO2О5Давайте сделаем это в соответствии с алгоритмом. Магний всегда двухвалентен.
Искомая валентность кислотного остатка равна III. Обратите внимание, что вещество всегда содержит элемент, имеющий постоянную валентность.3При составлении уравнений реакций необходимо синтезировать формулы веществ. Рассмотрим реакцию обмена между оксидом алюминия и соляной кислотой.4)2.
В результате обмена образуются два вещества синтеза AlCl и LE. Для количественной оценки синтеза в веществах мы будем использовать следующий алгоритм.
Составление химических формул на основе валентности
Уравнение имеет вид
Обратите внимание, что количество атомов в реактивах и продуктах разное, это должно быть уравновешено.
Давайте сформулируем формулы веществ на основе валентности элементов.
Как и валентность, некоторые элементы характеризуются стабильным состоянием окисления. Это металлы, которые характеризуются низким числом электронов во внешнем слое. Они характеризуются тем, что не могут иметь отрицательный заряд, потому что ВСЕГДА отдают электроны.
В отличие от металлов, есть один элемент, который ни при каких обстоятельствах не будет делиться своими электронами ни с кем. Ни при каких обстоятельствах он их не отдаст, это фтор, который всегда отрицательный F -.
Такой элемент, как кислород, обычно имеет отрицательный заряд, он раве н-2. А с одним только фтором он будет положительным +2.
Правила определения степени окисления
Ситуация аналогична водороду, свойство CO (степень окисления) — +1, но исключение составляют соединения с металлами, где степень окисления отрицательна и равн а-1.
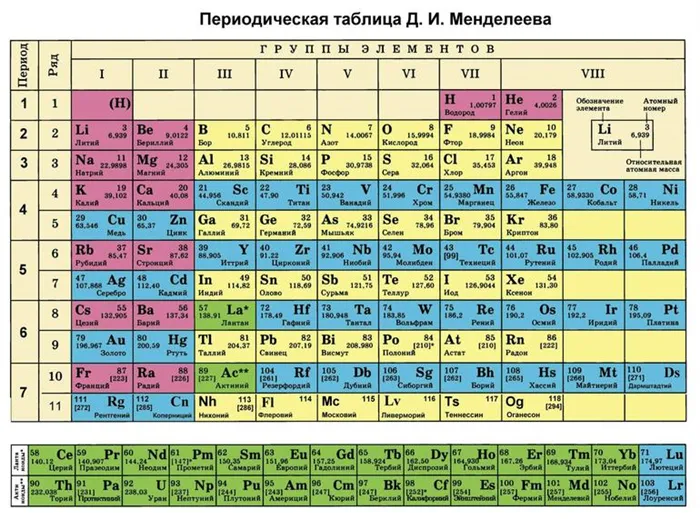
Все эти значения получены из периодической таблицы, которую можно использовать для определения состояний окисления элементов.
Источник
Из таблицы видно, что эта величина непостоянна для большинства элементов.
Для расчета степени окисления элементов в соединениях применяются следующие правила.
Давайте сыграем с вами в старую добрую игру «найди … отличия». Хотя они принадлежат к одной группе, у них одинаковая формула внешнего слоя ns 2 np 5, но валентность у них разная. Атомы хлора имеют свободную 3d плоскость, в которую при определенных условиях могут мигрировать электроны из внешнего слоя, создавая 3 возбужденных состояния. Атом фтора беден в этом отношении, у его электронов нет доступных d-орбиталей, его электронам некуда мигрировать. Поскольку он имеет только 1 несвязанный электрон, он может образовать только одну связь.
Например, в веществе H
Самым электроотрицательным элементом является кислород, который равен как водороду, так и
В школе на уроках химии рассказывают о детальном строении элементов и атомов. Существует понятие валентности химических элементов, которое имеет смысл для веществ с молекулярным характером. Валентность бывает постоянной и переменной и варьируется от соединения к соединению. Единицей измерения является количество связей, которые образуют маленькие частицы с другими атомами или группами атомов.
Валентность представляет собой способность атомов образовывать химические связи путем присоединения других атомов. Исторические данные о молекулярной и атомной структуре веществ известны с древних времен.2SO3Определение в переводе описывает силу, созидание. Основной кризис начинается еще до открытия структуры атома. В природе химических соединений заложено, что они делят пары частиц на валентные электроны.
Число связей, которыми атом соединен с другими элементами, называется валентностью. Полярность облигаций не учитывается, поэтому индекс не имеет знака и не равен 0. В химических соединениях атомные частицы находятся в числовом соотношении.
Комбинации водорода H с различными микрочастицами:
Cl (хлор) связан с одним атомом водорода, O2 (кислород) — с двумя, азот (N) — с тремя и углерод — с четырьмя атомными частицами. В молекуле CO2 частица H связана с двумя атомами кислорода.2A. по-разному сочетается с другими элементами. Эта способность выражается числовой характеристикой.
Валентная характеристика:4Атом водорода связывается только с частью другого элемента; поэтому валентность принимается равной 1. С точки зрения химии, атом водорода имеет одну валентную единицу (B); он моновалентен.
Валентность химических элементов

Образование химической связи атома любого элемента равно количеству маленьких частиц водорода, соединившихся вместе. В молекуле хлористого водорода валентность Cl равна 1, а в молекуле воды валентность атома кислорода равна 2. В строительном блоке метане валентность B углерода равна 4. В химии валентные единицы обычно обозначаются латинскими цифрами I-X.
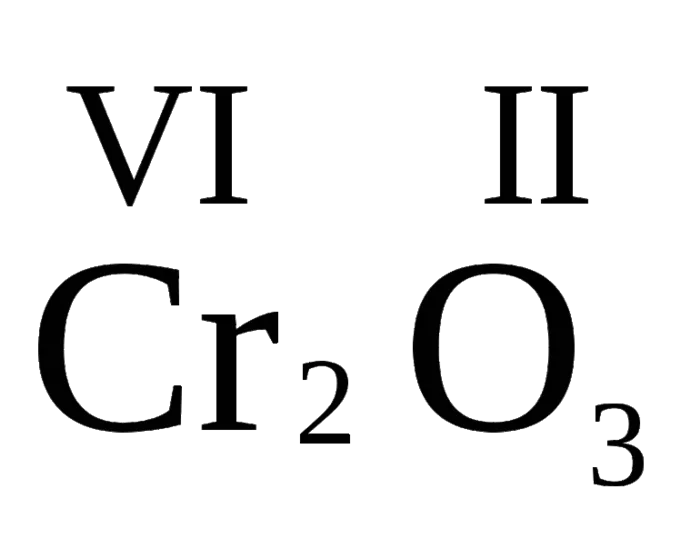
Общая характеристика
Скудные знания о структуре молекулярных и атомных частиц в 19 веке не позволяли объяснить причины, по которым атомы образуют связи с другими элементами. Стронций как основной принцип химии изучается и сегодня.
Необходимость и основные понятия
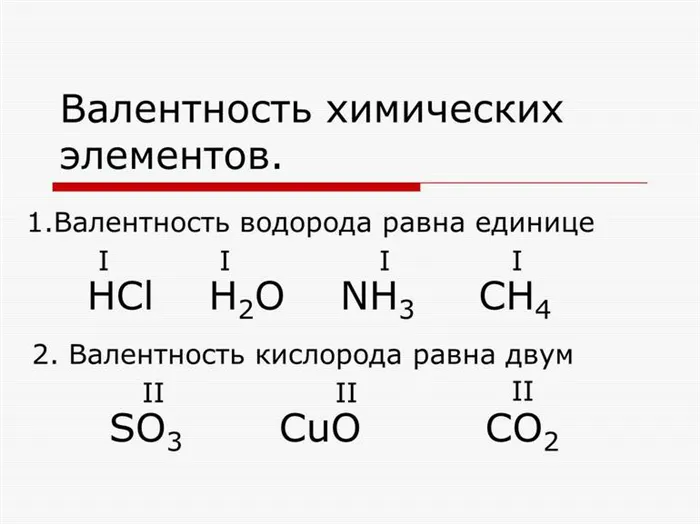
Ученый Э. Франкленд ввел в научные труды термин «связь» для описания взаимодействия атомов друг с другом. Он обнаружил, что некоторые элементы образуют связи с одинаковыми атомами. Азот связывает три частицы водорода, образуя молекулу аммиака.
Позже ученый сформулировал теорию о существовании определенного количества химических связей и назвал его «прочностью связи». Работа Франклина была
Максимальное В. — это значение Е. во внешней оболочке атома. Химические связи образуют Е. во внешней оболочке атома. При рассмотрении матрицы Менделеева становится ясно, что положение вещества в периодической таблице и его V. взаимосвязаны.
- Хлороводород (HCl).
- Вода (H2O).
- Аммиак (NH3).
- Метан (CH4).
Валентность:
Основой для образования соединений является акцептор электронов.
Типы электронов:
- HCl (I I).
- H2O (I II).
- HN3 (III I).
- CH4 (IV I).
Когда атом заряжен отрицательно и имеет неспаренные частицы для взаимодействия, образуется столько же неспаренных электронов, сколько существует неспаренных электронов.
В молекулярной структуре водорода и серы H2S последнее вещество наделено двойной валентностью (-), поскольку каждый атом участвует в образовании 2 пар электронов. Дефис указывает на притяжение пары к более негативному элементу. Наименьший минус имеет плюс в своем значении.
Историческая справка и взгляды ученых
Периодическая таблица содержит все 118 химических элементов (водород, литий, бор, натрий, магний, кальций, ванадий, уран и другие).

Химические и физические свойства отдельных веществ аналогичны элементу, который предшествует им в таблице. Регулярность наблюдается во всех элементах, кроме первых, поскольку они не содержат элементов, сходных по атомному объему с предшествующими им.
Валантиум из металлов:
Элемент
Труды Менделеева
Серебро
Теория электронов
I-III

Ртуть
I-II
Золото
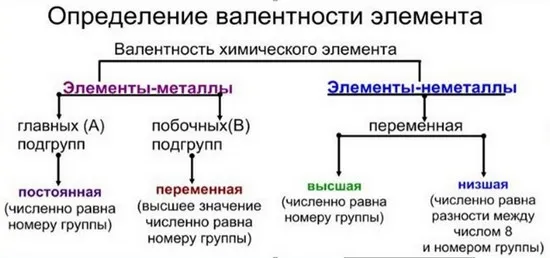
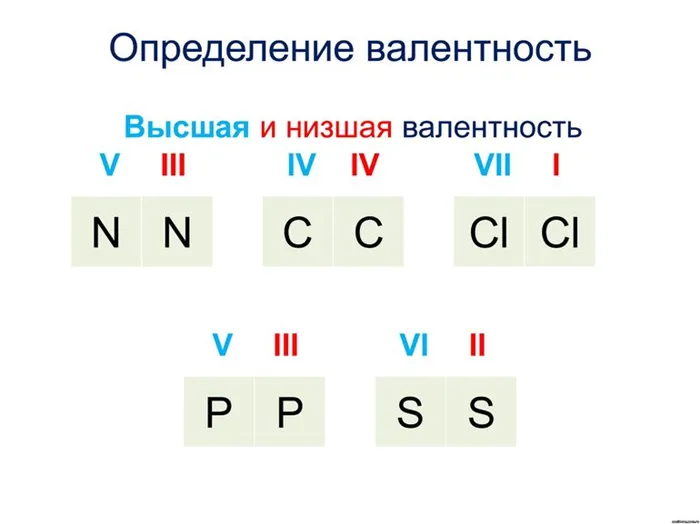
- Высшая. Соответствует порядковому № группы.
- Низшая. От числа вида по табличным данным отнимают номер интересующего элемента.
I-III
Никель
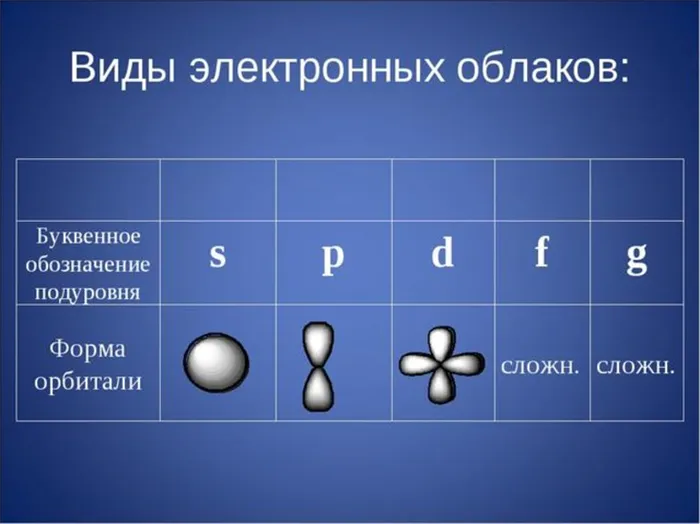
- Спаренные. Расположены на одной орбитали.
- Неспаренные. Это 1 электрон на орбитали.
I- IV
Мышьяк
Распределение свойств
-III, II, III, V
Вести
II-IV
| Кобальт | В |
| II-IV | Тинктадиен |
| II, IV | В периодической таблице элементы расположены в соответствии с атомным номером, электронной конфигурацией и повторяющимися химическими свойствами. Строки называются периодами, а столбцы — группами. Первая таблица содержала не более шестидесяти элементов, а теперь список вырос до 118 элементов. Систематизированы не только химические вещества, но и их свойства. |
| Химику достаточно взглянуть на таблицу, чтобы ответить на различные вопросы научного характера. | Тинктадиен |