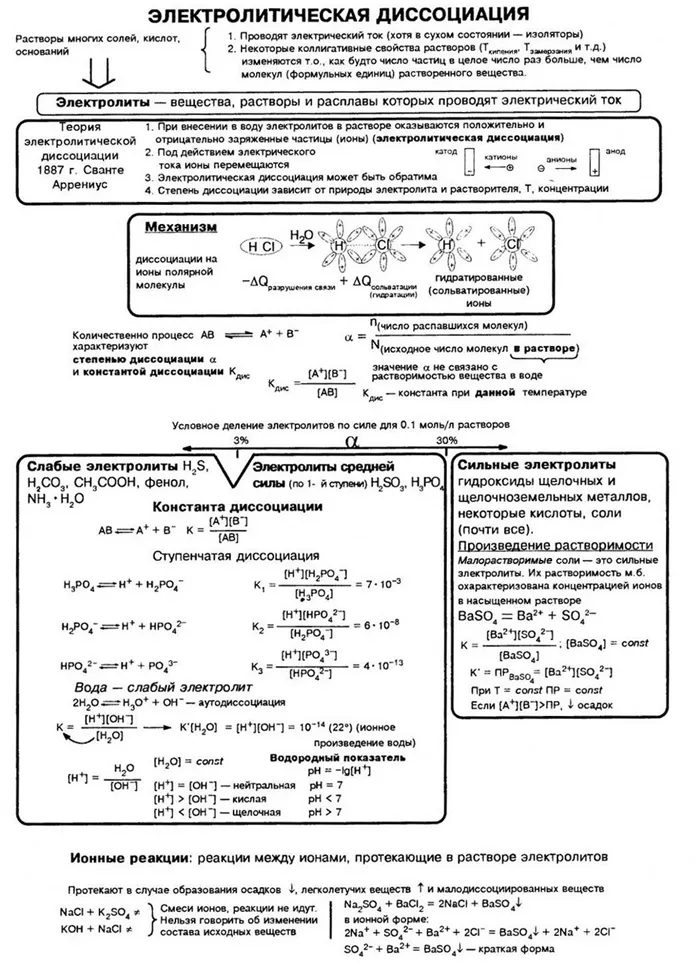
Теория электролитического разложения была усовершенствована. Современная теория водных электролитических растворов включает, помимо теории С. Аррениуса, концепции ионной гидратации (И. А. Каблуков, В. А. Кистяковский) и теорию сильных электролитов (П. Ж. Дебай, Э. А. Хюккель, 1923).
Теория электролитической диссоциации
Каков размер электролита? Что его вызывает и какие факторы влияют на его величину? Как мы можем научиться составлять уравнения диссоциации? Кто открыл способность некоторых растворов проводить электричество и почему великий русский химик Менделеев не получил Нобелевскую премию? Ответы на все эти вопросы вы найдете в этой статье.
Изучение решений занимало исследователей с древних времен. В начале 19 века М. Фарадей обнаружил способность некоторых растворов проводить электричество. Геймгольц, немецкий физик, предположил, что электролиты в растворе полностью разлагаются на ионы, т.е. происходит электролитическое разложение. Однако увеличение проводимости за счет снижения концентрации раствора объяснить не удалось.
Ученые заметили, что растворы замерзают при более низких температурах, чем чистые растворители. Это свойство растворов сегодня используется сторожами, которые обильно посыпают солью замерзшие тротуары. Однако температура замерзания электролитов не соответствовала расчетным данным.
Научные несоответствия требуют объяснения. И молодой, 29-летний шведский ученый С. Аррениус, исследуя в 1887 году проведение электрического тока в растворах различных веществ, сформулировал теорию, которая могла объяснить эти процессы.
Основные положения теории электролитической диссоциации
- Химические субстанции делятся на электролиты — вещества, которые проводят электрический ток, и неэлектролиты. К электролитам относится большинство сложных неорганических веществ: кислоты, основания, соли. К неэлектролитам — большинство органических веществ.
- В воде электролиты распадаются на ионы: положительно заряженные катионы и отрицательно заряженные анионы. Ионы бывают простые и сложные. В растворе ионы находятся в хаотическом движении.
- Под действием электрического тока движение ионов упорядочивается, и катионы движутся к отрицательному полюсу — катоду, анионы к положительному аноду.
- На степень электролитической диссоциации влияют различные факторы: природа растворенного вещества и его количество, свойства растворителя, температура раствора.

Учебник был написан профессорами химического факультета Московского государственного университета имени М.В. Ломоносова. Книга отличается простым и понятным изложением, высоким научным уровнем и большим количеством иллюстраций, опытов и рекреационных экспериментов, что делает ее подходящей для классов и школ с углубленным естественно-научным образованием.
Степень диссоциации
В ходе научных исследований ученые заметили, что некоторые молекулы растворителя разделяются в растворе. Для количественной оценки прочности электролита был введен показатель степени диссоциации, обозначаемый α, который рассчитывается по следующей формуле.
Где n — количество вещества, растворенного в ионах,
ν0— общее количество вещества.
Степень диссоциации также может быть выражена в процентах. Как это сделать, объясняется в разделе 11 учебника по химии. 9 класс», под редакцией В.В. Еремина.
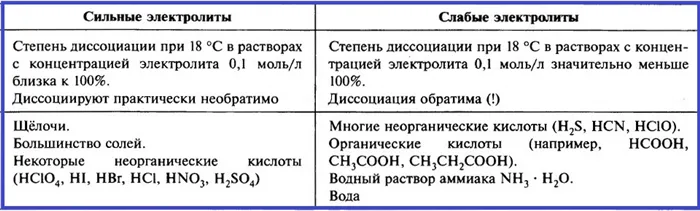
В зависимости от степени разложения вещества делятся на сильные и слабые электролиты.
Сильные электролиты — это вещества, которые почти полностью распадаются на ионы в разбавленных растворах. Степень диссоциации больше 0,5 или 50
O. В результате по донорно-акцепторному механизму образуется еще одна ковалентная связь кислород-водород:
Примеры кислотного расщепления:
ОПРЕДЕЛЕНИЯ ОСНОВАНИЙ, КИСЛОТ И СОЛЕЙ
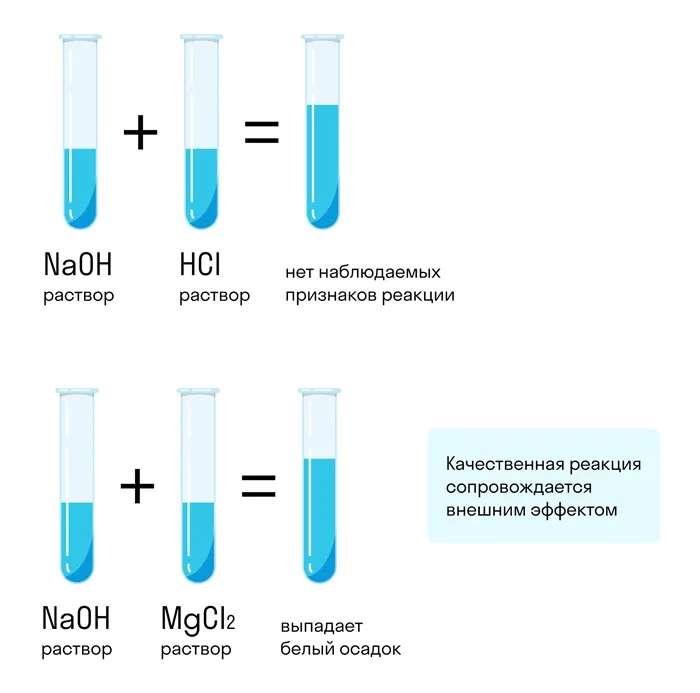
HCl = H + + Cl — или HCl + HO = HO + Cl — HC lO
= H + C lO
— или HC lO2O = H
O + C lO3O + ).
Полибазовые кислоты делятся на стадии:2Соли — это электролиты, которые в водном растворе расщепляются на металлические катионы и кислотные остаточные анионы.
Промежуточные соли отделяются с образованием только катионов металла и кислотных остаточных анионов. Например:
Соли аммония содержат катион аммония вместо катиона металла. Например:2NH3Cl = NH4+ Cl —4Основные соли разделяются с образованием катионов металла, анионов OH и кислотных остаточных анионов:4+ H2NH3= Al 3+ + OH- + 2Cl —4–
Кислотные соли разделяются с образованием катионов металла, катионов водорода (гидроксона) и анионов кислотного остатка. Например:
Уравнение суммы: Ca(HCO
+ 2H
O = Ca 2+ + 2H
O + 2CO42-4Двойные соли — это соли, разложение которых приводит к образованию катионов нескольких металлов (или аммония и одного металла) и анионов кислотного радикала. Например, сульфат калия-хрома (хромово-калиевые квасцы):
Смешанные соли — это соли, при разложении которых образуются катионы одного металла и анионы различных кислотных остатков. Например, гипохлорит хлорида кальция (хлорная известь):

CaClOCl = Ca 2+ + Cl — + ClO -.2При растворении некоторых электролитов диссоциация практически завершается. Эти электролиты называются сильными электролитами. При растворении других электролитов диссоциация происходит лишь в незначительной степени, их называют слабыми электролитами.
Для количественной оценки силы электролита было введено понятие степени электролитической диссоциации.

Степень электролитической диссоциации (a) — это отношение количества вещества, растворенного в ионах электролита (n3)2дисс.2) к количеству вещества электролита, добавленного в раствор (n3всего.3Скорость диссоциации также выражается в процентах, т.е. 0%.
Степень электролитической диссоциации зависит от типа электролита, его концентрации в растворе и температуры. Степень электролитической диссоциации увеличивается с разбавлением и с повышением температуры.
Можно оценить прочность различных электролитов, сравнивая степень их электролитического разложения при одинаковых условиях:
Все об электрическом разложении в одной таблице.
Описание курса «Электролитическое разложение. Степень диссоциации».
СТЕПЕНЬ ДИССОЦИАЦИИ
Электролитическое разложение — это процесс, при котором молекулы растворителя распадаются на ионы при взаимодействии с растворителем (водой). Разложение — это обратимый процесс.
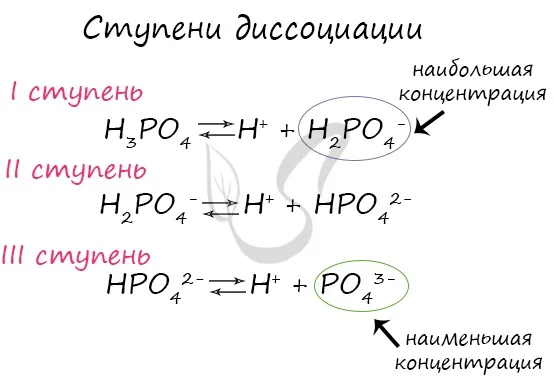
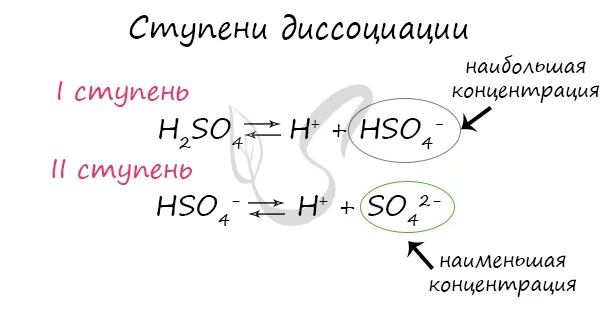
Разложение определяет ионную проводимость растворов электролитов. Чем больше молекул вещества разлагается на ионы, тем лучше проводится электрический ток и тем крепче электролит.На сайтеСледует отметить, что концентрация ионов на разных стадиях различна. Первые стадии всегда содержат много ионов, в то время как не все молекулы достигают последних стадий. Поэтому в растворе ортофосфорной кислоты концентрация дигидрофосфат-анионов выше, чем концентрация фосфат-анионов.В серной кислоте разложение происходит следующим образом:):
В средних солях разложение обычно происходит в один этап:<α<100%.
Из одной молекулы ортофосфата натрия образуется 4 иона.
Одна молекула сульфата калия производит 3 иона.
Всё об электрической диссоциации кратко в одной таблице.
Одна соль сульфата содержит 3 молекулы.
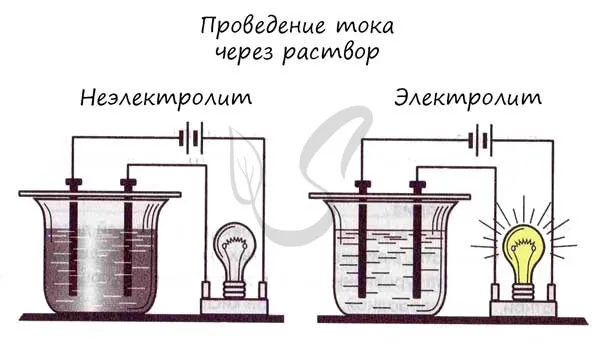
Химические вещества отличаются друг от друга по способности проводить электричество. На основании этой способности вещества делятся на электролиты и неэлектролиты.
Электролитическая диссоциация
Электролиты — это жидкости или твердые вещества, содержащие ионы, которые могут переносить и проводить электричество. Связи в их молекулах обычно ионные или ковалентные и сильно полярные.
К ним относятся соли, сильные кислоты и щелочи (растворимые основания).
Степень диссоциации сильных электролитов составляет от 0,3 до 1, что означает, что 30-100 % молекул растворяются в ионы в растворе.
Неэлектролиты — это вещества, которые не диссоциируют на ионы в растворе. Эти вещества имеют ковалентные неполярные или слабополярные связи.

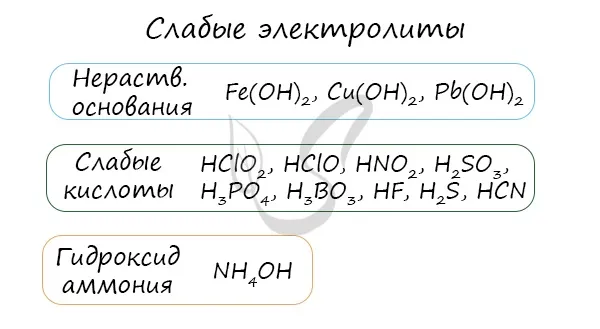
Многие органические вещества, слабые кислоты, нерастворимые в воде основания и гидроксид аммония являются неэлектролитами.
Скорость их разложения составляет от 0 до 0,3, т.е. до 30 % молекул неэлектролита распадаются на ионы. Они практически не проводят ток.
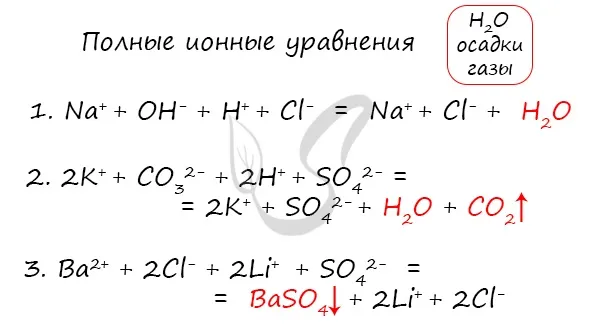
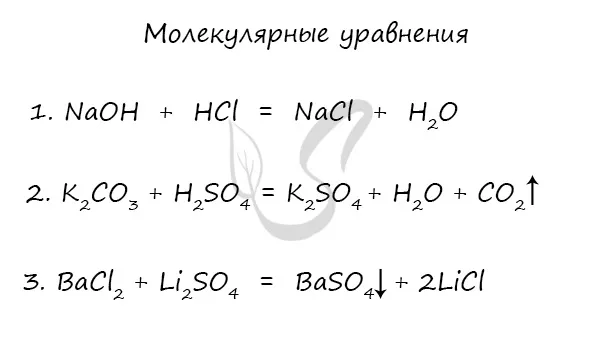
Молекулярные, полные и восстановленные ионные уравнения
Молекулярное уравнение — это запись реакции с использованием молекул. Это те уравнения, к которым мы привыкли и используем чаще всего. Примеры молекулярных уравнений:2SO4, H3PO4.