Чем активнее электролит, образующий ионы, тем он сильнее и тем выше постоянная. Более слабые имеют меньшую размерность константы. Значения констант диссоциации для различных элементов, составляющих матрицу Менделеева, приведены в справочниках. Эти значения действительны только для водных растворов. Химические элементы ведут себя по-разному в неводных растворах.
Электролитическая диссоциация
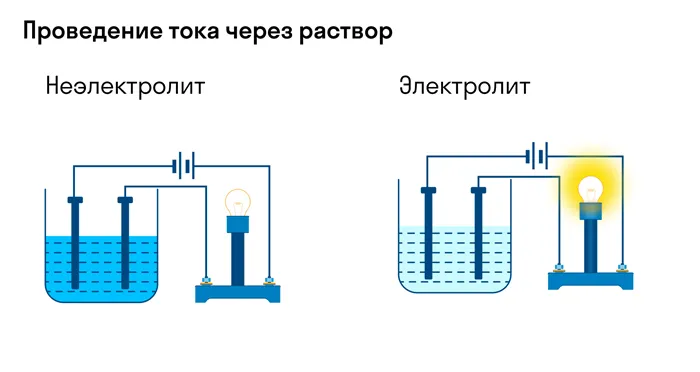
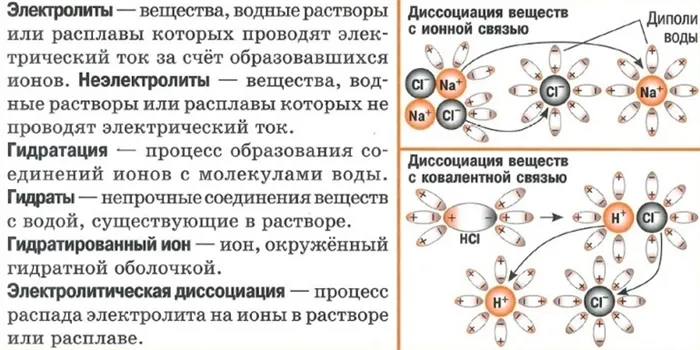
Водные растворы некоторых веществ являются проводниками электричества. Эти вещества называются электролитами. Кислоты, основания и соли, расплавы некоторых веществ являются электролитами.
Процесс разложения электролитов на ионы в водных растворах и расплавах под действием электрического тока называется электролитическим разложением.
Растворы некоторых веществ в воде не проводят электрический ток. Такие вещества называются неэлектролитами. Они включают многие органические соединения, такие как сахара и спирты.
Теория электролитической диссоциации
Теория электролитического разложения была сформулирована шведским ученым С. Аррениусом (1887). Основными положениями теории С. Аррениуса являются:
— Электролиты растворяются (разделяются) на положительно и отрицательно заряженные ионы при растворении в воде,
— положительные ионы движутся к катоду (катионы), а отрицательные ионы движутся к аноду (анионы) под действием электрического тока,
— Разложение — это обратимый процесс.
Механизм электролитического разложения основан на ионно-дипольном взаимодействии между ионами воды и диполями (Рисунок 1).
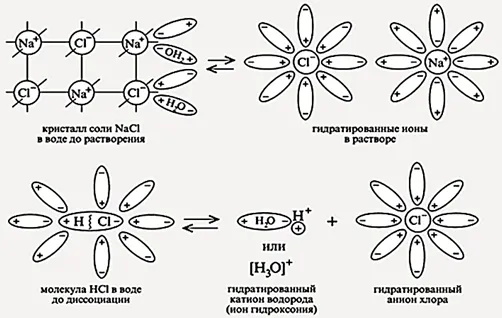
Рисунок 1. Электролитическое разложение раствора хлорида натрия.
Легче всего разделить вещества с ионными связями. Молекулы с полярной ковалентной связью (тип взаимодействия — диполь-дипольное) расщепляются аналогичным образом.
Диссоциация кислот, оснований, солей
Ионы водорода (H + ), а точнее гидроксильные ионы (H3O + ), которые отвечают за свойства кислот (кислый вкус, эффект маркера, взаимодействие с основаниями и т.д.).
При разложении оснований всегда образуются гидроксид-ионы водорода (OH — ), которые отвечают за свойства оснований (изменение цвета на маркерах, взаимодействие с кислотами и т.д.).
Соли — это электролиты, при разложении которых образуются катионы металлов (или катион аммония NH4+ ) и кислотные остаточные анионы.
Кислоты и полибазисные основания разделяются постепенно.
HSO4— ↔ H + + SO42- (шаг II)
Ca(OH)2↔ CaOH + + OH — (шаг I)
CaOH + ↔ Ca 2+ + OH —
Что такое электролитическая диссоциация
Как известно, электрический ток — это направленное движение свободных электронов или ионов, то есть заряженных частиц. В растворах электролитов, в которых возникает ток, за ток отвечают свободные ионы.
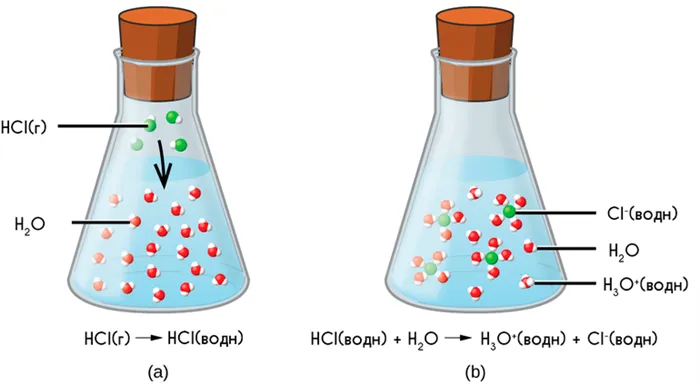
В 1882 году шведский химик С. Аррениус, исследуя свойства растворов электролитов, заметил, что они содержат больше частиц, чем присутствует в сухой массе. Например, раствор хлорида натрия содержит 2 молекулы частиц
Растворы электролитов приобретают способность проводить электричество в результате разложения. Сванте Аррениус не смог объяснить, почему различные вещества значительно отличаются по электропроводности, а Д. И. Менделеев смог. Он подробно описал процесс расщепления электролитов на ионы, который объясняется взаимодействием с молекулами воды (или других растворителей).
Схема электролитического разложения.
Уравнение разложения иллюстрируется на примере хлорида натрия: NaCl ⇄ Na + Cl — .
Иногда можно встретить выражение «теория электрических измерений», но так говорить нельзя. В этом случае можно предположить, что расщепление молекул на ионы происходит под действием электрического тока. В конце концов, процесс разложения не зависит от того, протекает ли в данный момент ток через раствор или нет. Все, что требуется, это контакт между электролитом и водой (растворителем).
Бесплатный урок для современных мам и пап от Екатерины Мурашовой. Зарегистрируйтесь и примите участие в розыгрыше 8 уроков
Все вещества с ионными связями могут разлагаться при контакте с водой или другими растворителями. Они также могут растворяться в ионах, поскольку ковалентные полярные связи под действием воды превращаются в ионы и затем растворяются.
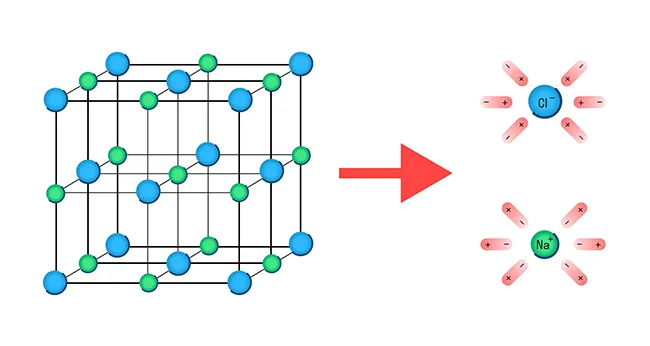
Механизм диссоциации электролита можно легко изучить на примере хлорида натрия NaCl. Его кристаллическая решетка состоит из катионов натрия Na+ и анионов хлора Cl-, которые удерживаются вместе ионными связями. При растворении в воде каждый кристалл хлорида натрия окружен молекулами хлорида натрия.

Механизм электролитической диссоциации
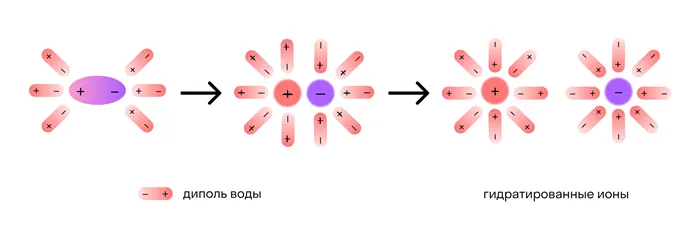
Обратите внимание, что молекулы воды являются диполями. На одном конце они несут атомы водорода с частичным положительным зарядом, а на другом конце — атомы кислорода с частичным отрицательным зарядом. Так, атомы кислорода притягиваются к катионам натрия, а атомы водорода — к анионам хлора. Это электростатическое притяжение ослабляет ионную связь между натрием и хлором и в конечном итоге разрушает ее. Вещество распадается на ионы.
После расщепления хлорида натрия образовавшиеся ионы Na+ и Cl- окружают молекулы воды и образуют водную оболочку. Ионы с такой оболочкой называются гидратированными ионами.
Если вместо воды используется другой растворитель — например, этанол, — молекулы образуют оболочку растворителя. В этом случае ионы называются растворенными ионами.
Процесс электролитического разложения показан на рисунке:
Хотя электролитическое разложение происходит независимо от действия электрического тока, между этими явлениями существует взаимосвязь. Чем больше способность вещества расщепляться на ионы при взаимодействии с растворителем, тем лучше оно притягивает электрический ток. По этому критерию известный физик-химик М. Фарадей различал электролиты и неэлектролиты.
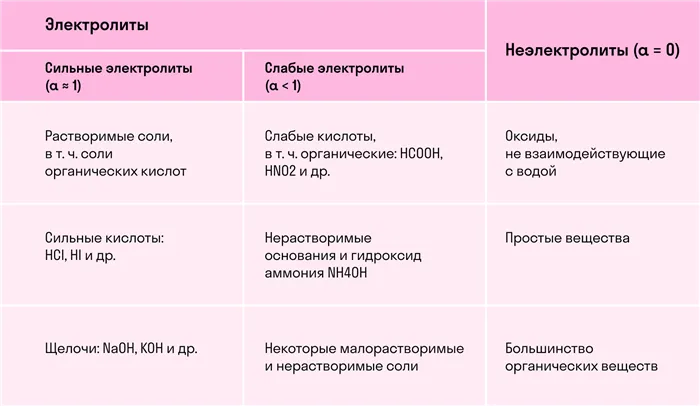
Электролиты — это вещества, которые после расщепления на ионы в растворах и расплавах пропускают через себя электрический ток. Их молекулы обычно имеют ионные или полярные ковалентные связи.
Электролиты и неэлектролиты
Неэлектролиты — это вещества, которые не разделяются на ионы в растворах и расплавах и поэтому не являются проводящими в растворенном виде. Они характеризуются ковалентно неполярными или слабополярными ковалентными связями.
Молекулы сильных электролитов необратимо распадаются на ионы, поэтому в уравнениях следует ставить знак =. Реакции со слабыми электролитами обратимы, отсюда и символ ⇄.
Занимайтесь по 15 минут в день. Изучайте английскую грамматику и лексику. Сделайте язык частью своей жизни.
Степень диссоциации
Вещества с ионной кристаллической решеткой разделяются более активно. Они уже состоят из мельчайших элементов, которые содержат положительно и отрицательно заряженные элементы. Молекула воды представляет собой диполь — два противоположно заряженных полюса. Частицы вещества притягиваются к ним, когда они растворяются. В то же время связи в кристаллической решетке ослабевают. Кристалл разрушается, и раствор насыщается элементами. Схематично процесс электролитического разложения можно представить следующим образом:
Разложение электролитов, состоящих из ковалентно связанных молекул, происходит аналогичным образом. Диполи воды воздействуют на молекулы вещества. Ковалентная связь преобразуется в ионную. Механизм разложения следующий:
В естественных условиях частицы в растворе движутся хаотично. В процессе некоторые из них сталкиваются и объединяются. Этот процесс называется ассоциацией. Если эти реакции выражены в виде формулы или уравнения электролитического разложения, то определяется знак обратимости. Это означает, что реакции в противоположных направлениях происходят одновременно. Гидроксиды, обладающие этим свойством, называются амфотерными веществами.
Некоторые слабые электролиты разделяются обратимо и постепенно. К ним относятся углекислота, сероводород и гидроксид магния. Гидратированные и негидратированные частицы имеют разные свойства. Например, катион или анион меди становится синим, когда он гидратирован. Когда он не увлажнен, он становится белым.
- слабые — ;
- средние — ;
- сильные — .
В гидратированном элементе число молекул воды может быть как постоянным, так и переменным.
В водном растворе вещества ионы и молекулы присутствуют одновременно. Их количество варьируется. Чтобы понять, сколько частиц находится в растворе в любой момент времени, химия разработала специальный показатель — степень диссоциации. Обычно он обозначается буквой «альфа» (a). Определение этого показателя следующее: a. — это отношение количества ионов к общему количеству частиц, растворенных в жидкости. Соотношение выражается в процентах (%) или долях.

Обратимость реакции
Если a = 100% или 1, это означает, что электролит полностью растворен в ионах. Если a = 0, реакция не происходит. Степень диссоциации варьируется от жидкости к жидкости. Он определяется исходными свойствами электролита. Интенсивность разложения также зависит от того, сколько электролита и воды присутствует в растворе. Чем выше концентрация соединения, тем ниже степень, и наоборот.

- Молекулы воды ориентируются вокруг частиц противоположно заряженными концами.
- Диполи взаимодействуют с ионами, расположенными в поверхностных слоях кристаллической решётки.
- Кристалл электролита диссоциирует с образованием гидратированных элементов.
В зависимости от способности разделяться на ионы, жидкости с электролитическим компонентом делятся на сильные и слабые. Самыми сильными являются те, кто реагирует полностью. Их степень диссоциации равна единице или 100%. Список самых сильных электролитов:
- Диполи воды притягиваются к полюсам электролита.
- Молекулы жидкого и твёрдого компонентов раствора вступают во взаимодействие.
- Ковалентная полярная связь преобразуется в ионную — происходит ионизация.
- Молекулы электролита распадаются на гидратированные ионы.
Степень диссоциации слабых электролитов почти всегда минимальна или стремится к нулю. Такие вещества практически не распадаются на элементарные частицы. Категории соединений, классифицируемых как слабые электролиты:
Определение степени
Типы электролитов

- щёлочи;
- сильные кислоты (серная, соляная);
- растворимые соли (хлориды, ацетат калия).
- вода;
- некоторые соли;
- водный раствор аммиака;
- слабые кислоты.