Энтальпия — это (с символом H) количество термодинамической (тепловой) энергии, содержащейся в веществе. Чтобы «запутать» реакцию, они иногда пишут ΔH 0 вместо +Q в экзотермической реакции, так как внутренняя энергия веществ увеличивается. Например:
Урок 13. Типы химических реакций
В уроке 13 «Типы химических реакций» из книги «Химия для чайников» мы узнаем о типах химических реакций; мы подробно рассмотрим каждый тип и научимся их различать.

Мир химических реакций очень разнообразен. В природе постоянно происходят различные химические реакции, и люди также осуществляют их. Можно ли классифицировать химические реакции? На каком основании производится классификация? Суть каждой химической реакции заключается в превращении веществ: Исходные вещества разрушаются, образуются продукты реакции, изменяется количество и состав исходных веществ и продуктов реакции. Характер этих изменений является основой для классификации химических реакций.
Реакции соединения
Рассмотрим уравнения следующих реакций (рис. 62):
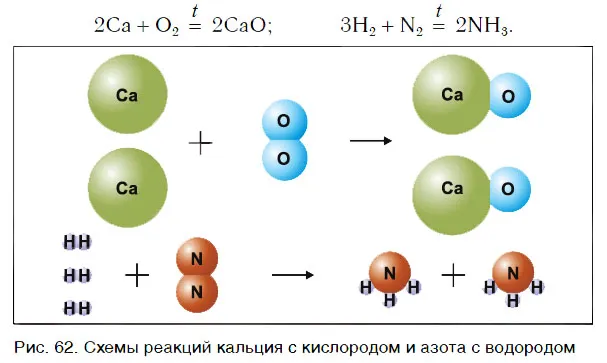
Чем похожи эти реакции? Потому что взаимодействие двух веществ приводит к образованию единого вещества. Эти реакции называются реакциями сопряжения.
Сложные реакции — это реакции, в которых два или более веществ объединяются с образованием нового сложного вещества.
В некоторых случаях два простых вещества объединяются в одно соединение, в то время как в других случаях объединяются два или более простых или сложных веществ:
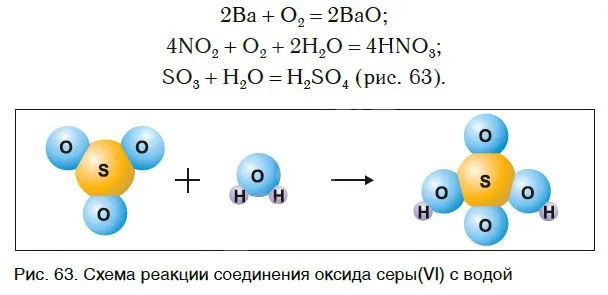
Реакции разложения
Рассмотрим уравнения следующих реакций:
Обратите внимание, что из одного составного вещества можно получить два или более новых веществ. Если соединение может состоять из двух или более соединений, то могут протекать две или более реакций. В этих реакциях могут образовываться как простые, так и сложные вещества.
Реакции разложения — это реакции, в которых из одного сложного вещества образуется несколько новых веществ.
Чтобы привести в движение реакцию разложения, исходные вещества обычно нагревают. Например, известь CaO образуется при нагревании CaCO3известняка, реакция разложения происходит при температуре около 1000 °C. Этот тип реакции представляет собой реакцию разложения метана CH4(рис. 64), компонент природного газа, является одной из таких реакций:
Классификация химических реакций
Существует несколько способов классификации химических реакций.
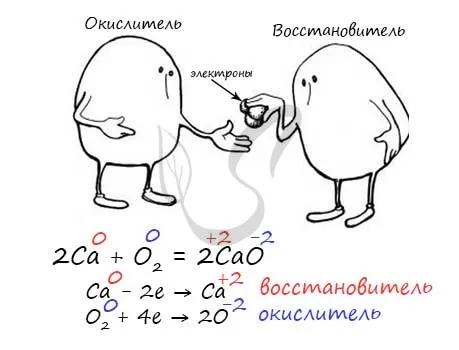
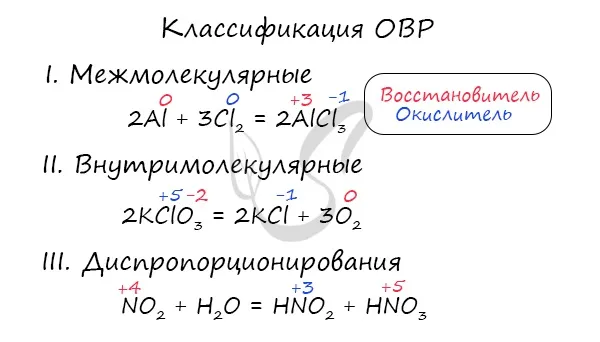
По изменению степени окисления
Все взаимодействия можно разделить на те, в которых степень окисления изменяется (ORR), и те, в которых она постоянна.

По количеству и структуре исходных и образующихся веществ
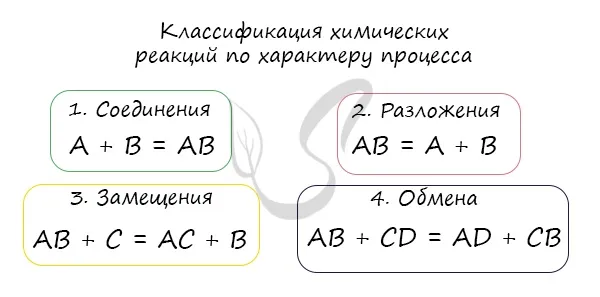
Химические реакции делятся на различные типы:
- соединения (из нескольких соединений синтезируется одно вещество – А + В = АВ);
- разложения (из одного вещества образуется несколько соединений – АВ = А + В);
- замещения (протекает между простым и сложным веществом, причем атом простого вещества замещает один элемент в сложном – А + ВС = АВ + С);
- обмена (сложные вещества обмениваются между собой элементами – АВ + СД = АД + СВ).
По выделению или поглощению теплоты
Химические взаимодействия могут происходить либо путем выделения, либо путем поглощения тепла. Количество тепла называется тепловым эффектом. Химические взаимодействия делятся на два типа:
- экзотермические(с выделением теплоты);
- эндотермические(с поглощением теплоты).
Теплота образования — это теплота эм
Скорость химической реакции выражается как изменение концентрации вещества в фиксированном объеме системы за определенный промежуток времени. Раздел химии, изучающий скорость химических взаимодействий и их зависимость от различных условий, называется химической кинетикой. Все взаимодействия веществ протекают с разной скоростью. Например, за 100 лет накапливается 0,5 мм капельного камня. Коррозия металлов также протекает медленно.
Сталактит
По направлению
Реакция занимает несколько часов при средней скорости. Примером может служить приготовление пищи с разложением и преобразованием соединений, содержащихся в пище.
- необратимые(проходят до конца, т.е. до абсолютного израсходования одного из реагирующих веществ);
- обратимые(протекают во взаимно противоположных направлениях).
Реакции нейтрализации протекают с высокой скоростью и могут быть опасны. Некоторые реакции протекают молниеносно и сопровождаются взрывом (взаимодействие калия или натрия с водой).
- выделение осадка;
- выделение газа;
- образование малодиссоциирующего соединения.
В гомогенных системах все частицы во всем объеме реагируют с одинаковой скоростью, тогда как в гетерогенных системах они реагируют только на поверхности. При горении угля, например, кислород реагирует только с атомами углерода на поверхности. При измельчении углерода реакция ускоряется.
Скорость химической реакции
Предположим, что уравнение гомогенной химической реакции выглядит следующим образом.
Концентрация вещества A в определенный момент времени (t
) является C
. Когда вещество А потребляется (t
Гомогенные реакции
), концентрация вещества A становится ниже, чем C
. Ставка может быть определена по следующей формуле:
Ставка может быть определена только в определенный момент времени.1В гетерогенных реакциях скорость не выражается концентрацией, потому что вещества реагируют не в объеме системы, а только на поверхности. Скорость определяется количеством молекул веществ, которые реагируют или образуются в единицу времени на единице площади. Площадь контакта постоянно меняется, поэтому расчеты носят специфический характер.1Катализаторы играют важную роль в ускорении химической реакции. Взаимодействие, происходящее с катализаторами, называется катализом. Замедление достигается за счет использования ингибиторов. Такие реакции называются ингибированием.2Катализаторы используются как в гетерогенных, так и в гомогенных средах. Промежуточные соединения образуются с помощью катализаторов. Например, для получения этанола из этилена используются катализаторы (серная кислота). Этилен не реагирует с водой, но с серной кислотой химическое взаимодействие протекает следующим образом:2Полученное соединение вступает в реакцию с водой:
Этилсульфат — это промежуточный продукт, который увеличивает скорость химических взаимодействий.
Гетерогенные реакции
Многие каталитические реакции протекают в гетерогенной среде. Серная кислота, например, образуется в результате окисления оксида серы (VI) на производстве. Дробленый оксид ванадия (V) V
Катализаторы
. Каталитические свойства химической реакции усиливаются в основном состоянии только в том случае, если вещество пористое. Роль адсорбции в гетерогенных реакциях велика по двум причинам:
Повышение температуры является необходимым условием для активации молекулы, поскольку химические связи начинают разрываться. Катализаторы позволяют увеличить скорость катализа за счет увеличения скорости разложения молекулы.
Растворение является результатом диффузии. Химические реакции взаимодействия с водой называются гидратацией. В результате получаются водные растворы — однородные системы, состоящие из молекул воды, частиц растворителей и продуктов их взаимодействия. Этого мнения придерживался и изобретатель периодической таблицы Дмитрий Иванович Менделеев.
Химические реакции оживили планету миллиарды лет назад и остаются важной частью жизни сегодня. Они не прекращают работу ни на минуту. Химические взаимодействия происходят в человеческом организме каждую секунду, так же как и вне его.
Если вы думаете, что химические реакции могут происходить только в научной лаборатории, вы сильно ошибаетесь. На самом деле, такие реакции происходят каждую минуту каждого дня повсюду на нашей планете, в том числе и в организме человека. Например, когда вы едите пищу, ваш организм преобразует ее в энергию посредством химических реакций. Горение дерева, покрытие металла ржавчиной и фотосинтез в растениях — все это примеры химических реакций.2O5Понятно, что не все химические реакции протекают с одинаковой скоростью. Некоторые из них начинаются и заканчиваются в течение нескольких секунд, например, взрыв, в то время как другим требуется некоторое время для завершения, например, образование ржавчины или темный цвет серебра.
- адсорбированные молекулы реагирующих веществ тесно соприкасаются;
- притяжение реагирующих молекул к поверхности катализатора ослабляет существующие в них химические связи.
На скорость реакции могут влиять несколько факторов: солнечный свет, тепло, давление или электричество могут значительно ускорить ее.
Роль воды в химических реакциях
Чтобы привести реакцию в движение, необходимо определенное количество энергии. Порох, например, никогда не взрывается сам по себе, но требует энергии в виде искры. Это иногда называют энергией активации. И все вещества нуждаются в этой энергии, даже в небольших количествах, независимо от их химической активности.
- реакционной среды;
- фактора диссоциации;
- катализатора;
- реагента;
- транспорта веществ.
Экзотермические реакции — это реакции, при которых выделяется тепло. Примером такой реакции в повседневной жизни является работа многоразового солевого нагревателя. Солевая грелка представляет собой емкость с насыщенным солевым раствором с аппликатором внутри. При сгибании аппликатора физиологический раствор переходит из жидкого в твердое состояние. Этот процесс сопровождается выделением тепла, и грелка нагревается. Эндотермические реакции происходят за счет поглощения тепла. Примером такой реакции является приготовление пищи. Чтобы сделать сырые продукты съедобными, необходимо провести несколько химических реакций, большинство из которых требуют постоянного притока тепла из внешней среды.
- растворимые (в 100 г воды растворяется более 1 г вещества) – гидроксиды щелочных металлов, низшие спирты, моносахариды и др.;
- малорастворимые (в 100 г воды растворяется 0,1-1 г) – гидроксид кальция, фторид бария, сульфаты серебра и свинца и др.;
- практические нерастворимые (вещество не растворяется в любом объеме воды) – фосфаты и карбонаты, высшие спирты и др.

Где происходят химические реакции?