Fe2O3+ HCl → FeCl3+ H2O (амфоксид + кислота = соль + вода; обратите внимание, что CO Fe = +3 не изменяется в ходе реакции).
Химические свойства кислот
От изготовления лекарств до приготовления пищи — кислоты помогают людям во многих сферах жизни. В этом материале мы рассмотрим типичные свойства и реакции кислот с другими химическими веществами.
20 декабря 2021 года
— Обновление 25 октября 2022 года
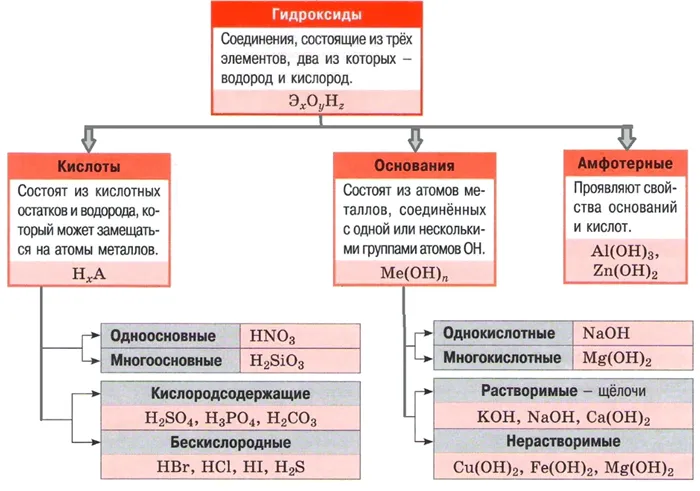
Кислоты — это сложные химические вещества, состоящие из одного или нескольких атомов водорода, которые могут быть замещены атомами металла, и кислотных радикалов.
Кислоты обладают определенными общими химическими свойствами: Диссоциация и расщепление, взаимодействие с металлами, основаниями, солями, основными и амфотерными оксидами.
Некоторые кислоты характеризуются особыми свойствами. Все кислоты проявляют определенную окраску на индикаторах.
Рассмотрим подробнее общие свойства кислот.
Диссоциация
Кислоты являются электролитами, которые диссоциируют с образованием катионов водорода и ионов кислотного остатка. Разложение кислот происходит поэтапно. Кислоты делятся на две группы в зависимости от их способности к разделению:
Бесплатный урок для современных мам и пап от Екатерины Мурашовой. Зарегистрируйтесь и примите участие в розыгрыше 8 уроков

Разложение
В результате реакций разложения кислот, содержащих кислород, образуются оксид кислоты и вода. Кислоты без кислорода образуют простые вещества. Для разложения некоторых кислот требуется тепло или излучение (HCl, HNO3, H3PO4), в то время как другие самопроизвольно разлагаются в процессе образования (H2CO3, H2SO3HNO2).
Металл может вытеснять водород из кислоты, только если металл находится слева от водорода в ряду активности металла. Продуктами реакции являются соль и водород.

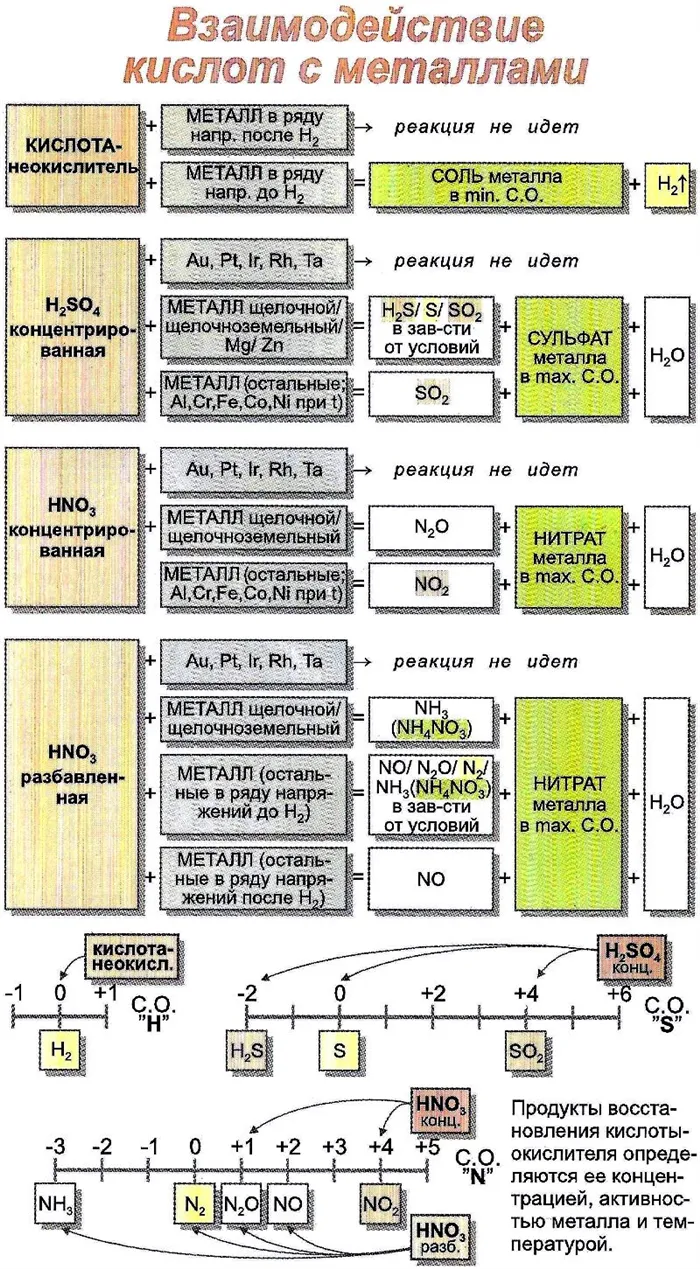
При взаимодействии с окислительными кислотами, такими как азотная кислота, образуется продукт восстановления до кислоты, хотя путь реакции также неясен.
Высокая окислительная способность серной и азотной кислот позволяет им вступать в реакцию с металлами. Продукты реакции зависят от активности металла и концентрации кислот.
Таблица: химические свойства кислот-окислителей
Холодная пассивация
Холодная пассивация
Реакция не происходит
Холодная пассивация
Холодная пассивация
Занимайтесь по 15 минут в день Освоить английскую грамматику и лексику. Сделайте язык частью своей жизни.

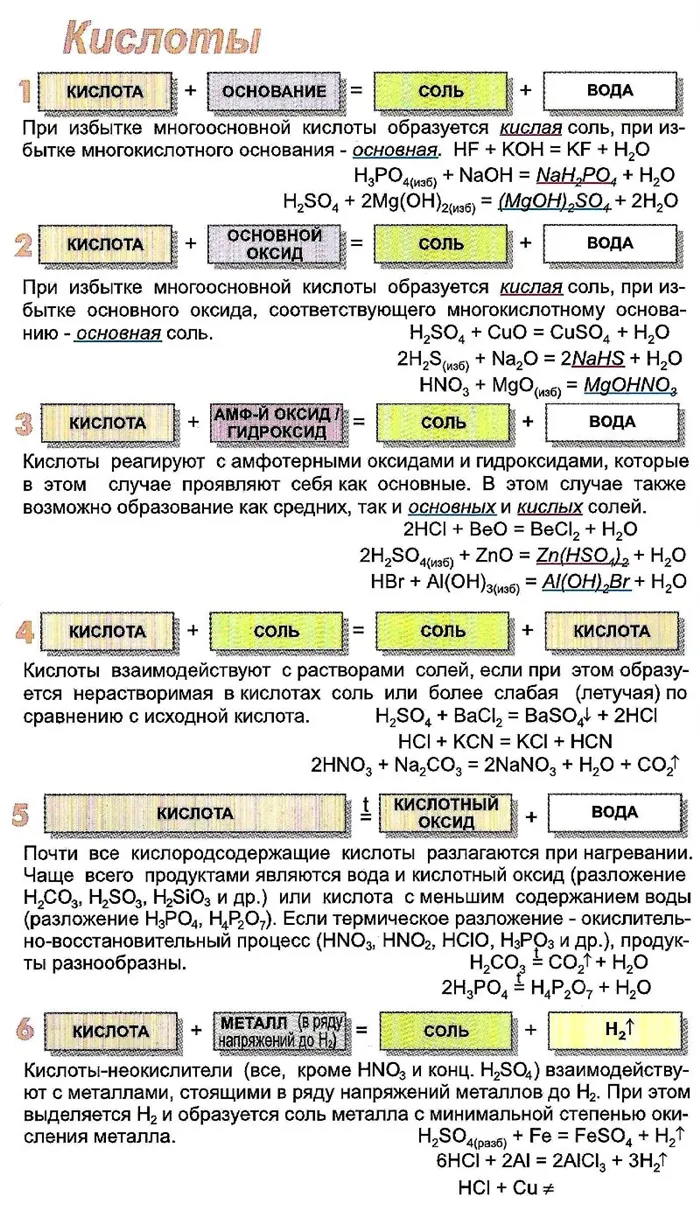
Взаимодействие с металлами
Из предыдущих тем вы знаете, что многие кислоты в водных растворах реагируют с металлами, расположенными слева от H2(В результате этих реакций образуются сложные вещества — соли — и выделяется водород, простое газообразное вещество:

Как без кислорода (HCl, HBr), так и с кислородом (H2SO4, H3PO4) кислоты, например:

Реакции такого рода, как вы уже знаете, относятся к реакциям замещения: Атомы металла замещают (вытесняют) атомы водорода из молекул кислоты.
Следует помнить, что металлы в активном ряду — это те, которые в последовательности2Как вы уже знаете, эти реакции являются реакциями обмена, поскольку при взаимодействии исходные соединения обмениваются своими компонентами.
Реакции с основными оксидами
Изучая химические свойства оснований, вы узнали, что они реагируют с кислотами, образуя соли и воду. Что образуется при взаимодействии кислот с основаниями? Правильно, те же продукты — соли и вода! Мы еще раз убедились, что состав конечных веществ не зависит от того, в каком порядке смешиваются одни и те же исходные вещества. Поэтому давайте составим схему, по которой кислоты реагируют с основаниями:
Помните, что в полученной соли валентность атомов металла такая же, как у исходного основания, а валентность кислотного остатка такая же, как у исходной кислоты.

Кислоты, например, реагируют как с нерастворимыми, так и с растворимыми основаниями:

Этот тип реакции, как и предыдущий, является реакцией обмена. Вспомните название реакции, указанное в последнем уравнении. Почему она так называется?
Взаимодействие с основаниями
Бескислородные кислоты, состоящие из двух элементов, можно получить путем синтеза простых веществ:

Кислородсодержащие кислоты могут быть получены при взаимодействии соответствующих кислотных оксидов с водой:
Р
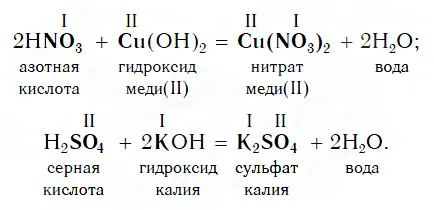
+ 3 H
ПОЛУЧЕНИЕ КИСЛОТ

O = 2H
SO
Слабые или летучие кислоты могут быть вытеснены из солей более сильными или менее летучими кислотами. Например, сильная соляная кислота HCl вытесняет слабую уксусную кислоту CH2O5UNH:2C H3Р O4COONa + HCl = C H3+ H2O = H2SO4
COONa + NaCl C H3ТАК — + N + = S H H
COON3Летучие кислоты могут быть вытеснены из солей менее летучими кислотами. Например, нелетучая серная кислота H3может вытеснить более летучую соляную кислоту HCl. Однако эта реакция не будет протекать в растворе (обе кислоты являются сильными). Это возможно, если обработать соль в кристаллическом состоянии (не в растворе) концентрированной серной кислотой:3В результате этой реакции образуется газообразный хлористый водород, который при растворении в воде дает соляную кислоту.3Для получения слабых нелетучих кислот (например, ортофосфорной кислоты или серной кислоты) предпочтительно использовать концентрированную серную кислоту, а полученную серную кислоту H

преобразуется в диоксид серы SO2SO4и вода:
Ca
(P O2SO3(твердое вещество) + 3H2(твердый .) = 3CaSO
+ 2H3Na4)2(твердый .) + H2SO4(конденсат .) = Na4+ SO3Р O4Конспект урока по химии в 8 классе «Кислоты: классификация, свойства, получение». Выберите другое действие:2SO3Седьмой пункт в классификации кислот обозначает их окислительные свойства. Уже отмечалось, что кислоты бывают в виде слабых и сильных окислителей. Подавляющее большинство кислот (почти все, кроме H2SO44 (концентрированный)2SO4и HNO2↑ + H2O
Дополнительные материалы (схемы, таблицы)
) являются слабыми окислительными кислотами, поскольку они увеличивают свою окислительную способность только за счет водорода k
- Вернуться к Списку конспектов по химии
- Найти конспект в Кодификаторе ОГЭ по химии
- Найти конспект в Кодификаторе ЕГЭ по химии
- Смотреть конспект по химии в 11 классе « Неорганические и органические кислоты «
Взаимодействие кислот с металлами
Список металлов, на которые они действуют, гораздо шире и включает все металлы, которые идут перед водородом в порядке активности, а также почти все металлы, которые следуют за ним. Это означает, что концентрированная серная кислота и азотная кислота любой концентрации также окисляют неактивные металлы, такие как, например, медь, ртуть и серебро. Взаимодействие азотной кислоты и концентрированной серной кислоты с металлами, а также с некоторыми другими веществами будет рассмотрено отдельно в конце этой главы в связи с их спецификой.2SOКак уже упоминалось, азотная кислота в любой концентрации и серная кислота только в концентрированном состоянии являются очень сильными окислителями. В частности, в отличие от других кислот, они окисляют не только металлы, стоящие впереди водорода в порядке активности, но и почти все последующие металлы (кроме платины и золота).Например, они способны окислять медь, серебро и ртуть. Однако не следует забывать, что некоторые металлы (Fe, Cr, Al), хотя и достаточно активные (до водорода), не реагируют с концентрированной HNO3и концентрированная H
без нагрева благодаря явлению пассивации — на поверхности этих металлов образуется защитная пленка из твердых продуктов окисления, которая не позволяет молекулам концентрированных серной и азотной кислот проникнуть вглубь металла для протекания реакции. Однако при сильном нагревании реакция происходит.2SO4При взаимодействии с металлами необходимыми продуктами всегда являются соль соответствующего металла и используемая кислота, а также вода. Кроме того, всегда выделяется третий продукт, природа которого зависит от многих факторов, таких как активность металлов, концентрация кислот и температура реакции.3Высокая окислительная способность концентрированной серной и концентрированной азотной кислот позволяет им реагировать не только почти со всеми металлами в диапазоне активности, но и со многими твердыми неметаллами, особенно с фосфором, серой и углеродом. В следующей таблице наглядно показаны продукты взаимодействия серной и азотной кислот с металлами и неметаллами в зависимости от их концентрации:
Все бескислородные кислоты (кроме HF) могут проявлять восстановительные свойства под воздействием различных окислителей благодаря химическому элементу, входящему в состав аниона. Например, все галогенные кислоты (кроме HF) окисляются диоксидом марганца, перманганатом калия и дихроматом калия. Галогенид-ионы окисляются до свободных галогенов:
Из всех галогенированных кислот соляная кислота обладает наибольшим восстановительным действием. В отличие от других гидрогалогеновых кислот, гидрогалогеновые кислоты также могут быть окислены оксидами железа и солями трехвалентного железа.3Сероводородная кислота H2SO4S. Даже такой окислитель, как диоксид серы, может его окислить:
Восстановительные свойства бескислородных кислот
2